Moskva, Moscow, Russian Federation
Moskva, Russian Federation
Moskva, Moscow, Russian Federation
Moskva, Russian Federation
Moskva, Moscow, Russian Federation
VAK Russia 14.01.2013
VAK Russia 14.01.2021
UDC 61
CSCSTI 76.29
BISAC MED038000 Hematology
BISAC MED080000 Radiology, Radiotherapy & Nuclear Medicine
Extraosseous manifestations are found in less than 5% of patients with multiple myeloma. Involvement of the gastrointestinal system in the course of multiple myeloma (MM) is extremely rare. Imaging is required for correct staging, in the followup after treatment and is predictor of prognosis. Several imaging technologies are used for the diagnosis and management of patients with MM. Conventional radiography, computed tomography (CT), magnetic resonance imaging (MRI) and nuclear medicine imaging - positron emission tomography (PET) combined with CT (PET/CT) and PET combined with MRI (PET/MRI) are all used in clarifying the extent of bone and soft tissue lesions in MM. The brief literature review on extramedullary lesions in MM and their imaging with recommendations is given. We describe the imaging in diagnostics and management of an rare case of secondary extramedullary plasmacytoma (EMP) in relapse involving the pancreas and duodenum with the bleeding in a patient with MM, IgA lambda, stage II, after 6-years treatment with chemotherapy, autologous peripheral blood stem cell transplantation and radiotherapy. EMP was detected by PET/CT before the appearance of obvious clinical signs, and then EMP was monitoring by PET/CT, X-ray and ultrasound.
Myeloma, Extramedullary plasmacytoma, Pancreas, Duodenum, Imaging, Magnetic Resonance imaging, Computer tomography, Positron Emission tomography, X-ray, Radiation diagnostics, Ulrasound
Сокращения
IMWG - International Myeloma Working Group
ISS – International staging system
ММ – множественная миелома
SUV - Standardized Uptake Value, стандартизированное значение поглощения [радиофармпрепарата]
ауто-ТГСК - аутологичная трансплантация гемопоэтических стволовых клеток
ВОЗ - Всемирная организация здравоохранения
ДПК – двенадцатиперстная кишка
ЖКТ – желудочно-кишечный тракт
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
ПЭТ-КТ – позитронно-эмиссионная томография, совмещенная с компьютерной томографией
ПЭТ-МРТ – магнитно-резонансная томография, совмещенная с компьютерной томографией
УЗИ – ультразвуковое исследование
18F-ФДГ - 18F-фтордезоксиглюкоза
ЭМП - экстрамедуллярная плазмоцитома
Введение
Множественная миелома (ММ), также известная как миелома плазматических клеток («плазмоклеточная миелома»), cогласно классификации Всемирной организации здравоохранения (ВОЗ) 2017 г., представляет собой злокачественное онкологическое гематологическое заболевание, характеризующееся клональной пролиферацией плазматических клеток в костном мозге с перепроизводством структурно однородных иммуноглобулинов [1]. ММ составляет около 1% всех злокачественных новообразований и примерно 10-15% всех гематологических злокачественных онкологических заболеваний и вызывает 20% смертей от злокачественных онкологических гематологических заболеваний [1,2]. Сведения об эпидемиологических особенностях заболевания немного разнятся, что связано с дизайном проведенных исследований. ММ чаще встречается у мужчин, чем у женщин (соотношение 1,4:1) и чаще у лиц негроидной расы. 90% случае заболевания приходится на возраст более 50 лет с медианой около 70 лет. Диагностика проводится на основании комплекса клинических, лабораторных, лучевых методов исследования. Диагностические критерии симптоматической миеломы включают в себя: присутствие в костном мозге ≥10 % клональных плазматических клеток или наличие подтвержденной биопсией костномозговой или экстрамедуллярной плазмоцитомы и 1 или несколько симптомов: гиперкальциемия >11,5 мг/дл (>2,75 ммоль/л); дисфункция почек: креатинин в сыворотке крови >2 мг/дл (>173 ммоль/л), клиренс креатинина <40 мл/мин; анемия: нормохромная нормоцитарная, гемоглобин на 2 г/дл (20 г/л) меньше нижней границы нормы или < 10 г/дл (<100 г/л); 1 или более остеолитических очагов; клональных плазмоцитов в костном мозге >60 %; соотношение свободных легких цепей (СЛЦ): ≥100 или ≤0,01; более 1 очага поражения костного мозга; другие симптомы: гипервязкость, амилоидоз, частые бактериальные инфекции (>2 эпизодов в течение 12 мес.) [1,3]. Клинические проявления ММ чрезвычайно разнообразны, но в значительной мере определяются инфильтрацией плазматическими клетками костного мозга и органными повреждениями. Клинические признаки ММ определяются разнообразными симптомами: костными повреждениями (боли в костях, переломы костей, компрессия спинного мозга, радикулярные боли), гиперкальциемией (полиурия, полидипсия, тошнота, рвота), почечной недостаточностью (тошнота, рвота, недомогание, слабость), амилоидозом (периферическая нейропатия, отеки, органомегалия), инфильтрацией миеломными клетками костного мозга (анемия, геморрагический синдром), снижением уровня нормальных иммуноглобулинов (частые инфекции, пневмонии), криоглобулинемией (синдром Рейно, акроцианоз), синдромом гипервязкости (одышка, транзиторные ишемические атаки, тромбоз глубоких вен, кровоизлияния в сетчатку глаза, тромбоз центральной вены сетчатки или ее ветвей, носовые кровотечения) [1,3,4]. Поражение костной ткани встречается в 80-90% случаях первичной диагностики [4,5].
К группе опухолей плазматических клеток относится и экстрамедуллярная плазмоцитома (ЭМП) – редкое заболевание, на которое приходится 3-5 % всех опухолей плазматических клеток [1,6]. ЭМП может быть первична и вторична при других опухолях плазматических клеток. ЭМП чаще встречается у мужчин (66-75%) с возрастной медианой 55 лет [6,7]. При вторичном процессе ЭМП чаще встречается единственная локализация – в 84% случаев, в большинстве - 85% случаев - ЭМП локализуется около костей скелета [8]. Частота встречаемости вторичной ЭМП повышается при увеличении длительности заболевания ММ и может быть связана с применением современных препаратов для химиотерапии [8–10] и реинфузией аутологичных периферических гемопоэтических стволовых клеток [10,11]. ЭМП встречается у 7 – 18 % больных при первичной диагностике ММ и у 20 % больных с ММ при ее рецидивировании [9].
ЭМП чаще встречается (в более 80% из 869 описанных с 1905 по 1997 гг. случаев) в ЛОР-органах (носовая полость, придаточные пазухи носа, носоглотка, среднее ухо), верхних отделах дыхательного и пищеварительного тракта (ротоглотка, гортаноглотка, гортань, гланды, трахея, пищевод) и поражает шейные лимфатические узлы. Кроме этого, ЭМП встречалась в эпидермисе, средних и нижних отделах дыхательной системы и желудочно-кишечного тракта, органах мочеполовой системы. Поражение желудочно-кишечного тракта (ЖКТ) (пищевод, желудок, тонкий кишечник и толстая кишка), других органов пищеварительной системы (поджелудочной железы (ПЖ), печени и желчевыводящих путей) встречалось крайне редко, большая часть ЭМП выявлялась в желудке и толстой кишке. ЭМП в ПЖ и двенадцатиперстной кишке (ДПК) отмечались в 6 и 3 случаях [6]. За период с 1998 г. по 2018 г. было описано более 20 новых случаев поражения ЖКТ [11,12]. В публикациях Talamo G. et al. сообщают о поражении ПЖ в восьми случаях, а ДПК - в двух случаях в этот период [11]. При ретроспективном исследовании 61 случая поражения тонкого кишечника говорилось о 20 случаях ЭМП с поражением ДПК, 24 случаях – с вовлечением в процесс тощей кишки и 17 - подвздошной кишки [12]. Вторичная ЭМП при ММ встречается намного чаще, чем первично выявленная ЭМП без других поражений, однако при анализе этих случаев оказалось, что ЭМП была первичной в почти всех из них, что может свидетельствовать об особенностях бессимптомного течения ЭМП этой локализации. Длительное протекание патологического процесса в ДПК, тощей и подвздошной кишки обычно характеризуется язвенными или ишемическими некротическими поражениями или инфильтрацией [4-7]. Одновременное поражение ЭМП ДПК и ПЖ описывалось в двух случаях [11–13]. В 30-40% случаев при первичной диагностике или рецидиве визуализируются вовлеченные в процесс регионарные лимфатические узлы [14]. Особенностями клинической картины ЭМП ЖКТ является зависимость выраженности симптомов от объема опухолевого инфильтрата, его локализации, наличия обструкции и вовлечения соседних органов. Наиболее частыми симптомами являются боль, тошнота, рвота, запор, потеря веса. Желудочно-кишечные кровотечения, кишечная непроходимость, желтуха, асцит при ММ и ЭМП встречается крайне редко [11,12,15–18]. Более, чем в трети описанных случаев отмечалось бессимптомное течение заболевания и обнаруженные образования были случайной находкой при КТ [11,19].
Для определения стадийности и прогноза ЭМП используются классификации ММ [20,21], также были предложены классификации ЭМП по стадиям с использованием двух независимых факторов – поражения лимфатических узлов и объема выявленной опухоли [22].
Лучевая диагностика ММ и ЭМП
В соответствии с рекомендациями IMWG, выбор метода лучевой диагностики ММ зависит от клинических проявлений симптомов и локализации костномозговых и/или внекостномозговых поражений [23].
Наиболее распространенный метод исследования - классическая рентгенография костей скелета, повсеместно рекомендованная ранее, имеет диагностические ограничения: чувствительность по данным разных исследователей не превышает 50-75% [24]. Суммарная доза классической рентгенографии костей скелета составляет 1,2 - 2,4 mSv.
Низкодозная КТ всего тела рекомендуется и считается предпочтительной по сравнению с классическими рентгеновскими исследования костей скелета [23]. Суммарная доза при КТ всего организма, достаточная для точной диагностики поражений, составляет по данным разных авторов 3,2 – 4,8 mSv [25].
У 5-25% больных с отрицательными результатами классической рентгенографии, при выполнение низкодозной КТ всего тела выявлялись поражения костей скелета [25], что особенно важно при диагностике поражений позвоночника и таза [26]. В некоторых случаях КТ всего тела может выявлять и внекостномозговые поражения. КТ комфортнее для пациентов из-за более удобного положения больного при диагностике и меньшего времени исследования.
ПЭТ с 18F-фтордезоксиглюкозой (18F-ФДГ) выявляет повышенное поглощение препарата клетками опухоли из-за повышенного метаболизма в них, но не дает дополнительных преимуществ по сравнению с КТ. ПЭТ-изображение с поглощением 18F- ФДГ имеет ограниченные возможности из-за небольшого разрешения объемно-пространственного изображения, для чего ПЭТ следует объединять с КТ для определения точной топографически-анатомической локализации и уточнения объема поражения, что особенно важно для первоначальной диагностики солидных ЭМП, несекреторной миеломе и динамики заболевания [27–30].
Позитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ-КТ) может быть также использована вместо КТ всего тела, при этом методика выполнения исследования должна соответствовать техническим требованиям к КТ всего тела [23].
МРТ – наиболее чувствительный и специфичный метод диагностики инфильтрации, особенно костного мозга на ранних этапах его поражения [31]. МРТ обладает высокой способностью визуализировать поражение мягких тканей и костного мозга. Для диагностики поражений позвоночника МРТ является «золотым стандартом». Обычная МРТ диагностирует ММ путем оценки картины инфильтрации. Динамическая контрастная МРТ диагностирует ММ путем оценки васкуляризации и перфузии. Диффузионно-взвешенная визуализация позволяет оценить состав и клеточность костного мозга при ММ [32,33].
Дополнительным преимуществом МРТ всего тела является редкая необходимость введения контрастных веществ на основе соединений гадолиния и их большая безопасность по сравнению с йод-содержащими контрастными веществами, применяемыми при КТ [34].
Минимальные технические требования к проведению исследований (МРТ всего тела и МРТ) указаны в рекомендациях IMWG [35]. МРТ позвоночника и таза является приемлемой альтернативой МРТ всего тела для обеспечения достаточно информативного изображения костного мозга [23,35].
В последнее десятилетие появились данные исследований об использованием новой перспективной методики использования ПЭТ-МРТ в диагностике онкологических заболеваний [36].
Высокая разрешающая способность, топографическая точность локализации и информативность исследований ПЭТ-КТ и МРТ позволяет не только выявить наличие поражения костного мозга и/или внекостномозговые поражения, но и определить точную локализацию, протяженность и объем опухолевого поражения, тем самым определять динамику развития локального процесса, рецидивирование, ответ на терапию.
После химиотерапии или применения факторов роста возможны ложноположительные результаты ПЭТ-КТ и МРТ, чаще встречающиеся при ПЭТ-КТ.
ПЭТ-КТ более информативно при выявлении локальных поражений, а МРТ – при определении диффузной инфильтрации из-за большей разрешающей способности метода [37].
Клиническое наблюдение
Представляется клинический случай диагностики и динамического наблюдения ММ с внекостномозговыми проявлениями - поражением ДПК и головки ПЖ с развитием рецидивирующих кишечных кровотечений.
Мужчина, 65 лет, болен в течение 8 лет, с августа 2011 года, когда появились боли в области таза, при КТ выявлено разрушение костной ткани крыла правой подвздошной кости с наличием мягкотканного компонента размерами 5,2х4,0 см с компрессией правой подвздошной мышцы. При гистологическом исследовании определялась плазмоцитома. В миелограмме: плазматические клетки 3%; в крови: общий белок - 99 г/л, IgA- 40,0 г/л. При иммунохимическом исследовании: моноклональная секреция Аl - 37, 7 г/л; секреция белка Бенс Джонса l - 0,57 г/сутки, b2-m - 4,3 мг/л. Диагностирована ММ, II стадия по ISS, с секрецией парапротеина IgА лямбда, с поражением правой подвздошной кости; проводилась химиотерапия, аутологичная трансплантация гемопоэтических стволовых клеток (ауто-ТГСК). Через 1 год после начала заболевания отмечалась полная ремиссия заболевания.
Через 4 года после начала заболевания возник первый рецидив с деструкцией участка правой подвздошной кости 8,0 х 5,0 см, визуализированный при рентгенографии таза, подтвержденный иммунохимически (Ig Аl - 11,4 г/л); проводилась лучевая терапия, после чего к концу 4 года после начала заболевания отмечена вторая полная ремиссия.
Второй (локальный) рецидив с деструкцией правой ветви нижней челюсти возник через 5 лет после начала заболевания, был выявлен при ПЭТ-КТ и подтвержден иммунохимически (следовая секреция); проводилась химио- и лучевая терапия, отмечена третья полная ремиссия.
Через 6 лет от начала заболевания, во время третьего рецидива с образованием плазмоклеточных инфильтратов в лимфатическом узле шеи справа, в периампулярной зоне ДПК появились изъязвления подслизистой зоны ДПК, через 7 лет от начала заболевания осложнившиеся субкомпенсированным стенозом и рецидивирующими желудочно-кишечными кровотечениями с анемией тяжелой степени смешанного генеза (со снижением гемоглобина до 47 г/л).
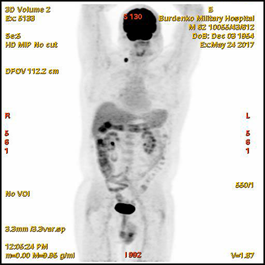
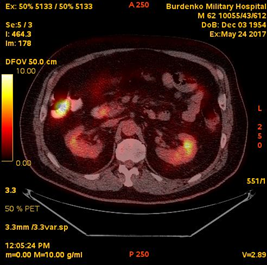
В мае-июне 2017 при ПЭТ-КТ (май 2017) выявлена активная специфическая ткань в гиперплазированном правом шейно-надключичном лимфатическом узле размером 16 мм (SUV 15,5); в медиальных отделах нисходящей ветви ДПК, в зоне Фатерова соска, отмечено локальное повышенное накопление РФП до 13 мм (SUV 7,0) (Рис. 1).
А. A. Б. B.
Рис. 1. ПЭТ-КТ (май 2017). На полученных изображениях в коронарной (А), и аксиальной (Б) плоскостях визуализируется накопление 18F-ФДГ (SUV 7,0) в области Фатерова соска на протяжении 13 мм (стрелка ¬), а также в правом шейно-надключичном лимфатическом узле (SUV 15.5) размером 16 мм (стрелка ®)
Fig.1. PET / CT (May, 2017). The resulting images in the coronary (A) and axial (B) planes visualize the over 13 mm focus of the 18F-FDG accumulation (SUV 7,0) in the papilla Vateri region (arrow ¬), as well as 16 mm focus in the right cervical-supraclavicular lymph node (SUV 15.5) (arrow ®)
В июне 2017 при УЗИ определялось образование пониженной эхогенности с четкими неровными контурами с гиперэхогенными включениями и гиперэхогенной капсулой размером 18х20 мм, интимно прилегающее к головке ПЖ, возможно, стромальная опухоль. При ФЭГДС в периампулярной зоне определялось округлое подслизистое образование размерами до 15 мм, возможно со связью этого образования с ПЖ, выполнена биопсия. При эндосонографическом исследовании визуализировалось округлое образование до 15 мм диаметром, выступающее в просвет ДПК и покрытое неизмененной слизистой. При дуоденоскопии в луковице ДПК на протяжении 10 см определяется экзофитное крупнобугристое образование, занимающее 2/3 окружности кишки.
При иммуногистохимическом исследовании биоптатов образования ДПК морфологическая картина соответствовала ММ. Диагностирован рецидив заболевания. На фоне проводимой химиотерапии развилось желудочно-кишечное кровотечение.
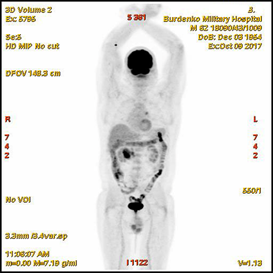
В октябре 2017 при проведенной ПЭТ-КТ в стенке нисходящей ветви ДПК определялись: циркулярное мягкотканое утолщение до 13-25 мм на протяжении до 67 мм, с интимным взаимодействием с головкой ПЖ, с очагом гиперметаболической активности (SUV 11,2); очаги гиперметаболической активности: в головке ПЖ размером 10 мм (SUV 6,1); в парапанкреатических лимфатических узлах размерами 10-16 мм, в том числе на уровне тела ПЖ (SUV 3,9); в медиастинальных лимфатических узлах – нижнем паратрахеальном размером 16 мм и аортопульмональном размером 19 мм (SUV 4,6) (Рис. 2). Было диагностировано дальнейшее прогрессирование с продолженным локальным ростом плазмоцитом и положительным статусом минимальной остаточной болезни в костном мозге (0,042%), продолжена химиотерапия.
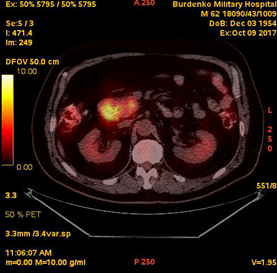
А. A. Б. В.
Рис.2. ПЭТ-КТ (октябрь 2017). На полученных изображениях в коронарной (А) и аксиальных (Б) плоскостях визуализируется циркулярное мягкотканое утолщение стенки кишки толщиной до 13-25 мм с очагом накопления 18F-ФДГ в области Фатерова соска (SUV11,2) размером 13 мм (стрелка®). В головке поджелудочной железы участок накопления 18F-ФДГ (SUV 6,1) размером 10 мм (стрелка ¬).
Fig.2. PET / CT (October, 2017). The obtained images in the coronary (A) and axial (B) planes visualize a circular soft-tissue thickening of the intestinal wall up to 13-25 mm with the over 13 mm focus of the 18F-FDG accumulation in the papilla Vateri region (SUV 11,2) (arrow®); the 10 mm focus of the 18F-FDG accumulation (SUV 6,1) in the head of the pancreas (arrow ¬).
В январе 2018 на фоне химиотерапии отмечалась отрицательная динамика, подтвержденная при ПЭТ-КТ: сохранялась субтотальная мягкотканая трансформация стенки нисходящей ветви ДПК размерами 37х21х39 мм (SUV 11,2); интимное взаимодействие опухоли кишки с головкой ПЖ, сужение просвета кишки до 11 мм; участок накопления в головке ПЖ размером 15 мм (SUV 6); парапанкреатические лимфатические узлы размером до 13 мм (SUV 2.9) (Рис. 3).
При ФЭГДС (январь 2018): в бульбарно-дуоденальном переходе и дистальнее на протяжении 8 см определялось экзофитное крупнобугристое образование, занимающее 2/3 окружности кишки.
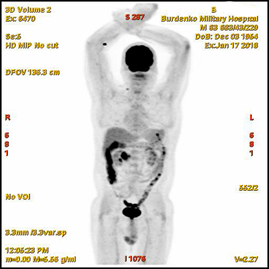
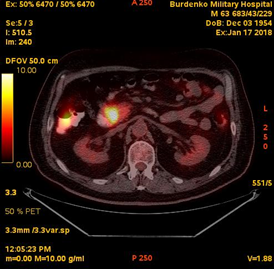
А. A. Б. B.
Рис.3. ПЭТ-КТ (январь 2018). На полученных изображениях в коронарной (А), и аксиальных (Б) плоскостях визуализируется накопление 18F-ФДГ в области Фатерова соска на протяжении 13 мм (стрелка®). Субтотальная мягкотканая трансформация стенки нисходящей ветви ДПК размерами 37х21х39 мм (SUV 11,2) с сужением просвета до 11 мм. В головке ПЖ участок накопления 18F-ФДГ (SUV 6) размером 15 мм (стрелка ¬).
Fig.3. PET / CT (January, 2018). The obtained images in the coronary (A) and axial (B) planes visualize the focus over 13 mm of the 18F-FDG accumulation in the papilla Vateri region (arrow ®); subtotal soft tissue transformation 37x21x39 mm (SUV 11.2) of the wall of the descending part of the duodenum with narrowing of the lumen of the duodenum up to 11 mm; the 15 mm focus of the 18F-FDG accumulation (SUV 6) in the head of the pancreas (arrow ¬).
В мае 2018 при ФЭГДС определялось злокачественное образование ДПК с изъязвлением на протяжении 12 см, стенозирующее просвет до 7 мм.
В июне 2018 по данным ПЭТ-КТ сохранялись патологические очаги гиперметаболической активности в субтотальной мягкотканой трансформации стенки левой половины нисходящей ветви ДПК размерами 50х28х56 мм (SUV12.6), в парапанкреатических лимфатических узлах уровня головки и тела ПЖ размерами 8-14 мм (SUV5.5); интимное взаимодействие опухоли кишки с патологически измененной головкой ПЖ размерами 30 мм (SUV 10.5) (Рис. 4).
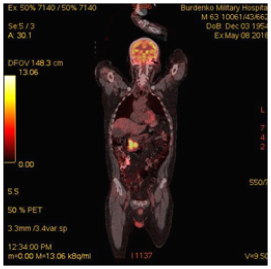
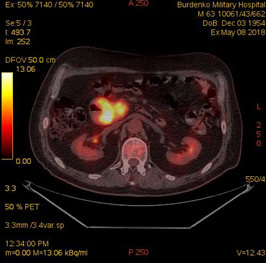
А. A. Б. B.
Рис.4. ПЭТ-КТ (май 2018). На изображениях в коронарной (А) и аксиальных (Б) плоскостях визуализируется накопление 18F-ФДГ в сохраняющейся гиперметаболически активной мягкоткано трансформированной стенке левой половины нисходящей ветви ДПК (SUV12.6) размерами 50х28х56 мм (стрелка ®). Сужение просвета ДПК до 8 мм. В головке патологически измененной ПЖ участок накопления 18F-ФДГ (SUV 10.5) размером до 30 мм (стрелка ¬).
Fig.4. PET / CT (May, 2018). The images in the coronary (A) and axial (B) planes visualize the accumulation of 18F-FDG in the remaining hypermetabolically active soft tissue transformed wall of the left half of the descending part of the duodenum (SUV12.6) 50x28x56 mm in size (arrow ®); narrowing of the lumen of the duodenum up to 8 mm; up to 30 mm focus of the 18F-FDG accumulation (SUV 10.5) in the head of a pathologically altered pancreas (arrow ¬).
В феврале 2019 на 8 году от начала заболевания появились рецидивирующие кишечные кровотечения с развитием анемии и снижением гемоглобина до 49 г/л.
В марте 2019 КТ органов грудной клетки и брюшной полости показало наличие образования ДПК с признаками инвазии в головку ПЖ, холедох; просвет ДПК на уровне нисходящего отдела составлял 2,5 х 1,5 см; выявлена внутрибрюшная лимфаденопатия (Рис. 5).
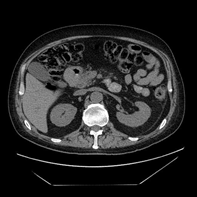
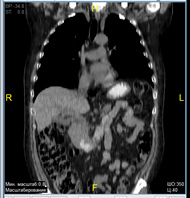
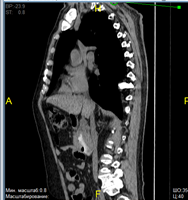
А. Б. В.
Рис. 5. КТ органов брюшной полости (март 2019). В аксиальном срезе (А), коронарной (Б) и сагиттальной (В) реконструкциях визуализируется сужение просвета и утолщение стенок ДПК на всем протяжении нисходящего отдела (стрелка ®). Инвазия образования в головку ПЖ (стрелка ¬). Увеличение количества внутрибрюшных лимфатических узлов (стрелка ¯).
Fig. 5. CT scan (March, 2019). The images in the axial section (A), coronary (B) and sagittal (C) reconstructions visualize the narrowing of the lumen and thickening of the walls of the duodenum all over the entire descending part of duodenum (arrow ®); invasion of the tumor in the pancreatic head (arrow ¬); an increase in the number of intra-abdominal lymph nodes (arrow ¯).
В феврале 2019 при УЗИ выявлены признаки диффузных изменений в паренхиме печени и подтвердены изменения ПЖ, а также увеличенное количество параортальных лимфатических узлов.
В феврале 2019 при ФЭГДС в постбульбарном отделе определялась полуциркулярная опухолевая инфильтрация с сужением просвета на протяжении 12 см диаметром до 7 мм за счет опухолевой инфильтрации с признаками распада; поверхность слизистой была ярко гиперемирована с наложениями фибрина, отмечалась контактная кровоточивость; проведена биопсия.
В исследованном биоптате стенки ДПК при окраске гематоксилин-эозином выявлены плазмоцитарные мономорфные клетки с эозинофильной цитоплазмой и эксцентрично расположенными ядрами (Рис. 6А). При иммуногистохимическом исследовании определялась реакция в опухолевых клетках с антителами к CD38+, CD138+, СD45-, что характерно для иммунофенотипа плазмоцитомы (Рис. 6Б).
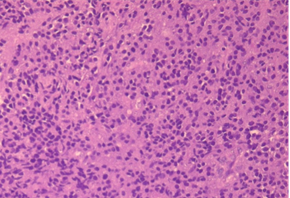
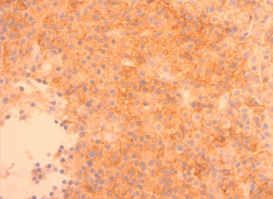
А. A. Б. B.
Рис. 6. Микропрепарат стенки ДПК. В биопсийном материале стенки ДПК при окраске гематоксилином-эозином (А) определяются мономорфные клетки с эозинофильной цитоплазмой и эксцентрично расположенными ядрами. При иммуногистохимическом исследовании (Б) определялась реакция в опухолевых клетках с антителами к CD38+, CD138+, СD45-.
Fig. 6. Sample of the tumor of duoudenum wall. When stained with hematoxylin-eosin (A), monomorphic cells with eosinophilic cytoplasm and eccentrically located nuclei are determined. An immunohistochemical study (B) determined the reaction in tumor cells with antibodies to CD38 +, CD138 +, CD45-.
В марте 2019 при рентгеноскопическом исследовании желудка от верхушки луковицы с переходом на постбульбарный и нисходящий отдел двенадцатиперстной кишки, до нижней горизонтальной части, на протяжении около 11 см определялось стойкое неравномерное циркулярное сужение просвета кишки в виде трубки диаметром до 0,5 - 0,9 см. На этом участке стенки кишки были ригидными, перистальтика не просматривалась; рельеф складок слизистой был разрушен, контуры неровные, четкие. В горизонтальной части ДПК не изменена. Эвакуация контрастного вещества из желудка и ДПК сохранялась (Рис. 7).
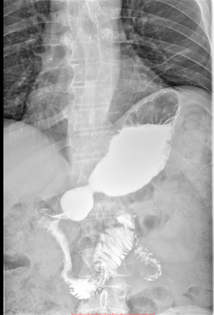
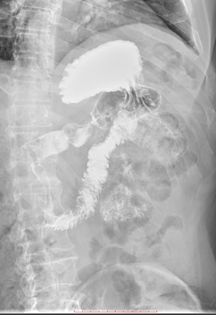
А. A. Б. B.
Рис. 7. Рентгеноскопия желудка (март 2019). При тугом наполнении (А) и двойном контрастировании (Б) визуализируется сужение нисходящего отдела двенадцатиперстной кишки на всем протяжении (стрелка ®).
Fig. 7. X-ray of the stomach (March, 2019) with tight filling (A) and double contrasting (B): the images visualize the narrowing of the lumen all over the descending part of the duodenum (arrow ®).
Констатирован дальнейший опухолевый рост, продолжена химиотерапия со сменой схемы.
После проведенного курса химиотерапии достигнута хорошая частичная ремиссия, кишечные кровотечения не рецидивировали, гемоглобин увеличился до 140 г/л. При контрольной КТ в июне 2019 отмечено, что ранее выявленные изменения в периампулярных отделах ДПК и забрюшинных лимфатических узлах полностью регрессировали (Рис.8).
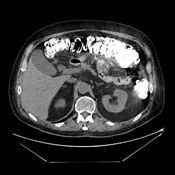
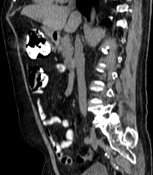
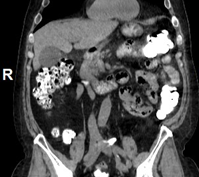
А. A. Б. B. В. C.
Рис. 8. КТ органов брюшной полости (июнь 2019). На изображения в аксиальном срезе (А), сагиттальной (Б) и коронарной (В) реконструкциях выявленное ранее сужение просвета и утолщение стенок 12-ти перстной кишки на всем протяжении нисходящего отдела не визуализируется (стрелка ®).
Fig. 8. CT scan (June, 2019). The images in the axial section (A), sagittal (B) and coronary (C) reconstructions visualize the previously revealed narrowing of the lumen and thickening of the walls of the duodenum all over the descending part of the duodenum (arrow ®).
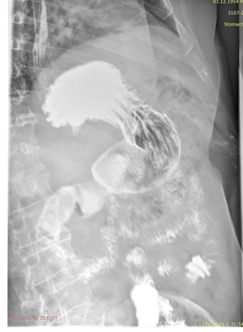
Пациенту выполнена контрольная рентгеноскопия желудка (июнь 2019), при которой отмечена положительная динамика в виде уменьшения объема опухолевой ткани, отсутствия стеноза ДПК и деформации ее стенок, восстановления перистальтики пораженного участка, хорошей эвакуации контраста из желудка и ДПК (Рис. 9).
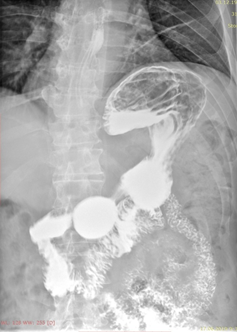
А. A. Б. B.
Рис. 9. Рентгеноскопия желудка (июнь 2019). При тугом наполнении (А) и двойном контрастировании (Б) визуализируется нормальная ширина просвета нисходящего отдела ДПК на всем протяжении (стрелка ®).
Fig. 9. X-ray of the stomach (June, 2019) with a tight filling (A) and double contrasting (B): the mages visualize the normal clearance of the duodenum all over the descending part of the duodenum (arrow ®).
При УЗИ ОБП (июнь 2019) отмечены признаки диффузных изменений в паренхиме печени и поджелудочной железы, парааортальная лимфаденопатия.
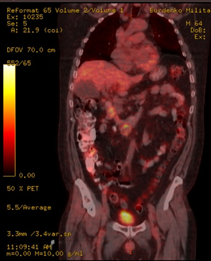
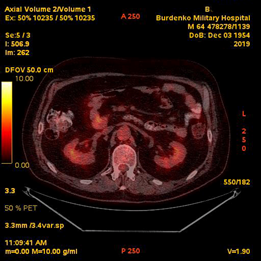
При проведении контрольной ПЭТ-КТ получены данные о снижении активной специфической ткани в образованиях ДПК и головке ПЖ (с уменьшением их размеров и интенсивности), а также в брыжеечных лимфатических узлах (с уменьшением размеров и интенсивности), с уменьшением специфической ткани в дуоденальных и забрюшинных лимфатических узлах (с увеличением их размеров); резорбция активной специфической ткани в правых надключичных лимфатических узлах (Рис. 10).
А. B. Б. B.
Рис. 10. ПЭТ-КТ. При контрольном исследовании на изображениях в коронарной (А) и аксиальных плоскостях (Б) визуализируется накопление 18F-ФДГ в узловом образовании ДПК/головке ПЖ (стрелка ®). Сужение просвета кишки не наблюдается.
Fig. 10. PET-CT. The images in the coronary (A) and axial planes (B) visualize the accumulation of the 18F-FDG in the tumor of the duodenum / pancreatic head (arrow ®). The narrowing of the lumen of the duodenum is not observed.
Обсуждение
В описанном клиническом наблюдении, как и в некоторых доступных нам описанных случаях вторичной ЭМП с внекостномозговым поражением, ЭМП манифестировала при длительном заболевании ММ при использовании в лечении современных лекарственных средств, высокодозной химиотерапии и реинфузий ауто-ТГСК.
По данным Alegre A., et al. [10], при рецидивах ММ после реинфузий ауто-ТГСК внекостные проявления составляют 14%, а из всех рецидивов менее 5% приходится на поражение ЖКТ. По данным Talamo G., et al. [11] вовлечение ЖКТ в опухолевый процесс происходит в 56% случаев рецидивов после реинфузии ауто-ТГСК, с медианой развития поражения через 30 месяца после процедур (риск сохраняется на протяжении, в среднем, до 60 месяцев).
При дифференциальной диагностике кровотечения из верхних отделов ЖКТ при ММ нужно исключать эрозивно-язвенные поражения, которые чаще связанные с приемом нестероидных противовоспалительных средств и/или глюкокортикостероидов. Реже – вне связи с ними - кровотечения возникают вследствие язвенной болезни желудка и двенадцатиперстной кишки, эрозивного гастрита и/или дуоденита; амилоидной инфильтрации стенки кишки, плазмоцитомой. Плазмоцитома ЖКТ может начинаться бессимптомно [38] и стать случайной находкой. Возможно ее проявление в виде неспецифических жалоб в виде периодически возникающие болей в эпигастрии, тошноты, рвоты, и, очень редко, кровотечениями. Эндоскопически плазмоцитома может выглядеть как эрозивно-язвенные гастро- и дуоденопатии, изъязвленные массы на поверхности слизистой а иногда, в виде утолщения желудочных складок или полипов [16,18,39].
Ранее в случае подозрения на объемное образование ЖКТ использовалась рентгеноскопическое исследование с двойным контрастированием, которое применяли с осторожностью при подозрении на непроходимость или на пенетрацию. В настоящее время этот метод используется редко из-за более широкого применения КТ и МРТ. С помощью КТ можно определить размер и распространенность опухолевого процесса, а также утолщение стенок полых органов (желудка, кишки).
Малосимптомность как костномозгового, так и внекостномозгового поражения при ММ делает лучевые методы исследования актуальными, особенно на ранних стадиях. В 10% случаев ММ с локализацией в костях или в мягких тканях может не сопровождаться клиническими проявлениями [3]. Учитывая слабо выраженные клинические и неспецифические симптомы заболевания, своевременное и полноценное применение лучевых методов являются основополагающими в определении распространенности и стадийности ММ и ЭМП.
Появление новых рекомендаций по обследованию [40,41], лечению ММ [2,5] и ЭМП [7] привело к более широкому применению новых диагностических методов исследования. Всем пациентам с ММ и ЭМП при первичной диагностике, перед началом лечения и для оценки эффективности терапии, при подозрении на рецидив или прогрессирование заболевания рекомендуется выполнять ПЭТ-КТ всего тела [34,37]. Следствием применения указанных рекомендаций в практике стало увеличение количества выявленных бессимптомных и малосимптомных поражений ММ и ЭМП на ранних стадиях развития заболевания. Но не все медицинские организации обладают возможностями применения наиболее информативных методов исследования, таких как КТ, МРТ и ПЭТ-КТ. Однако, успешное сочетание рентгеновских, ультразвуковых и радиоизотопных методов позволяет получить в диагностике объективную и полную картину поражения внутренних органов и систем, при контроле эффективности проводимой терапии.
ММ и ЭМП мягких тканей могут быть выявлены при УЗИ, а ЭМП в ЖКТ – при эндоскопическом исследовании. Мы выявили и наблюдали динамические изменения множественных ЭМП в ходе эволюции ММ с вовлечением ДПК, ПЖ и лимфатических узлов в процессе лечения, используя рентгеноскопию, КТ, ПЭТ-КТ и ЭГДС с эндосонографией. Гистологическое и иммуногистохимическое исследования биоптатов ДПК подтвердили ЭМП ДПК. Рентгеноскопическое исследование подтвердило изменения в ДПК, позволило оценить функциональное состояние кишки. Точная визуализация поражений при ПЭТ-КТ позволило оценивать клиническую эффективность лечения по динамике объема опухолевых клеток.
Заключение
Лучевые методы исследования позволяют не только диагностировать поражение органов и систем, или определить объем опухолевого поражения и наличие метастазов в других органах, но и давать ценную информацию о динамике заболевания и оценивать эффективность проводимой терапии при ЭМП у пациентов с ММ.
Предпочтительными лучевыми методами диагностики ММ и ЭМП являются низкодозная КТ всего тела, ПЭТ-КТ. Однако, ограничениями их использования являются высокая стоимость исследования, наличие данной аппаратуры только в крупных специализированных медицинских организациях.
Классические лучевые методы исследования органов брюшной полости и желудочного-кишечного тракта - рентгеновские и ультразвуковые исследования, являются менее информативными при ММ и ЭМП, но могут быть использованы с учетом их сочетания, чувствительности и целей исследования при отсутствии возможностей выполнить более высокотехнологичные лучевые методы исследования.
1. Swerdlow S, Campo E, Harris N, et al., eds. WHO Classification of Tumours of Hematopoietic and Lymphoid Tissues. Rev 4th ed. Lyon, France: International Agency for Research on Cancer (IARC); 2017.
2. Moreau P, San Miguel J, Sonneveld P, et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2017;28(suppl_4):iv52-iv61. doihttps://doi.org/10.1093/annonc/mdx096
3. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014;15(12):e538-48. doihttps://doi.org/10.1016/S1470-2045(14)70442-5
4. Terpos E, Kleber M, Engelhardt M, et al. European Myeloma Network Guidelines for the Management of Multiple Myeloma-related Complications. Haematologica. 2015;100(10):1254-1266. doihttps://doi.org/10.3324/haematol.2014.117176
5. Bird JM, Owen RG, D’Sa Sh, Snowden JA, Pratt G, Ashcroft J, Yong K, Cook G, Feyler S, Davies F, Morgan G, Cavenagh J, Low E, Behrens J JM. Guidelines for the diagnosis and management of multiple myeloma 2013. The Haemato-oncology Task Force of the British Committee for Standards in Haematology (BCSH), UK Myeloma Forum. https://www.ukmf.org.uk/guidelines-page/bshukmf-guidelines/. Published 2013. Accessed May 20, 2019.
6. Alexiou C, Kau RJ, Dietzfelbinger H, et al. Extramedullary plasmacytoma. Cancer. 1999;85(11):2305-2314. doihttps://doi.org/10.1002/(SICI)1097-0142(19990601)85:11<2305::AID-CNCR2>3.0.CO;2-3
7. Soutar R, Lucraft H, Jackson G, et al. Guidelines on the diagnosis and management of solitary plasmacytoma of bone and solitary extramedullary plasmacytoma. Clin Oncol (R Coll Radiol). 2004;16(6):405-413. doihttps://doi.org/10.1016/j.clon.2004.02.007
8. Varettoni M, Corso A, Pica G, Mangiacavalli S, Pascutto C, Lazzarino M. Incidence, presenting features and outcome of extramedullary disease in multiple myeloma: a longitudinal study on 1003 consecutive patients. Ann Oncol Off J Eur Soc Med Oncol. 2010;21(2):325-330. doihttps://doi.org/10.1093/annonc/mdp329
9. Alegre A, Granda A, Martínez-Chamorro C, et al. Different patterns of relapse after autologous peripheral blood stem cell transplantation in multiple myeloma: clinical results of 280 cases from the Spanish Registry. Haematologica. 2002;87(6):609-614. http://www.ncbi.nlm.nih.gov/pubmed/12031917.
10. Bladé J, Fernández de Larrea C, Rosiñol L, Cibeira MT, Jiménez R, Powles R. Soft-Tissue Plasmacytomas in Multiple Myeloma: Incidence, Mechanisms of Extramedullary Spread, and Treatment Approach. J Clin Oncol. 2011;29(28):3805-3812. doihttps://doi.org/10.1200/JCO.2011.34.9290
11. Talamo G, Cavallo F, Zangari M, et al. Clinical and biological features of multiple myeloma involving the gastrointestinal system. Haematologica. 2006;91(7):964-967. http://www.ncbi.nlm.nih.gov/pubmed/16818286.
12. Lopes Da Silva R. Extramedullary plasmacytoma of the small intestine: Clinical features, diagnosis and treatment. J Dig Dis. 2012;13(1):10-18. doihttps://doi.org/10.1111/j.1751-2980.2011.00544.x
13. Hefferman A. Plasmacytoma of pancreas and duodenum causing acute intestinal obstruction. Lancet (London, England). 1947;1(6461):910. doihttps://doi.org/10.1016/s0140-6736(47)91368-8
14. Hu K, Yahalom J. Radiotherapy in the management of plasma cell tumors. Oncology (Williston Park). 2000;14(1):101-108, 111; discussion 111-2, 115. http://www.ncbi.nlm.nih.gov/pubmed/10680152.
15. Wang C-C, Chang M-H, Lin C-C. A Rare Cause of Gastrointestinal Bleeding. Gastroenterology. 2013;145(3):e1-e2. doihttps://doi.org/10.1053/j.gastro.2013.05.005
16. Ammar T, Kreisel F, Ciorba MA. Primary Antral Duodenal Extramedullary Plasmacytoma Presenting With Melena. Clin Gastroenterol Hepatol. 2010;8(1):A32. doihttps://doi.org/10.1016/j.cgh.2009.03.005
17. Fowell AJ, Poller DN, Ellis RD. Diffuse luminal ulceration resulting from duodenal plasmacytoma. Gastrointest Endosc. 2007;65(4):707-708. doihttps://doi.org/10.1016/j.gie.2006.08.015
18. Daram SR, Paine ER, Swingley AF. Upper Gastrointestinal Bleeding in a Patient With Multiple Myeloma. Gastroenterology. 2012;142(2):e8-e9. doihttps://doi.org/10.1053/j.gastro.2011.02.069
19. Yasuda S, Hoshikawa T, Yazawa N, et al. A case of duodenal involvement of multiple myeloma imaged by positron emission tomography with 18F-fluorodeoxyglucose. Tokai J Exp Clin Med. 2001;26(4-6):147-151. http://www.ncbi.nlm.nih.gov/pubmed/12030445.
20. Greipp PR, San Miguel J, Durie BGM, et al. International staging system for multiple myeloma. J Clin Oncol. 2005;23(15):3412-3420. doihttps://doi.org/10.1200/JCO.2005.04.242
21. Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. J Clin Oncol. 2015;33(26):2863-2869. doihttps://doi.org/10.1200/JCO.2015.61.2267
22. Zhu Q, Zou X, You R, et al. Establishment of an innovative staging system for extramedullary plasmacytoma. BMC Cancer. 2016;16(1):777. doihttps://doi.org/10.1186/s12885-016-2824-x
23. Moulopoulos LA, Koutoulidis V, Hillengass J, et al. Recommendations for acquisition, interpretation and reporting of whole body low dose CT in patients with multiple myeloma and other plasma cell disorders: a report of the IMWG Bone Working Group. Blood Cancer J. 2018;8(10):95. doihttps://doi.org/10.1038/s41408-018-0124-1
24. Edelstyn GA, Gillespie PJ, Grebbell FS. The radiological demonstration of osseous metastases. Experimental observations. Clin Radiol. 1967;18(2):158-162. doihttps://doi.org/10.1016/s0009-9260(67)80010-2
25. Hillengass J, Moulopoulos LA, Delorme S, et al. Whole-body computed tomography versus conventional skeletal survey in patients with multiple myeloma: a study of the International Myeloma Working Group. Blood Cancer J. 2017;7(8):e599. doihttps://doi.org/10.1038/bcj.2017.78
26. Hinge M, Andersen KT, Lund T, et al. Baseline bone involvement in multiple myeloma - a prospective comparison of conventional X-ray, low-dose computed tomography, and 18flourodeoxyglucose positron emission tomography in previously untreated patients. Haematologica. 2016;101(10):e415-e418. doihttps://doi.org/10.3324/haematol.2016.146092
27. Zamagni E, Cavo M. The role of imaging techniques in the management of multiple myeloma. Br J Haematol. 2012;159(5):499-513. doihttps://doi.org/10.1111/bjh.12007
28. Nakamoto Y. Clinical contribution of PET/CT in myeloma: from the perspective of a radiologist. Clin Lymphoma Myeloma Leuk. 2014;14(1):10-11. doihttps://doi.org/10.1016/j.clml.2013.12.005
29. Agarwal A, Chirindel A, Shah BA, Subramaniam RM. Evolving role of FDG PET/CT in multiple myeloma imaging and management. AJR Am J Roentgenol. 2013;200(4):884-890. doihttps://doi.org/10.2214/AJR.12.9653
30. Walker RC, Brown TL, Jones-Jackson LB, De Blanche L, Bartel T. Imaging of Multiple Myeloma and Related Plasma Cell Dyscrasias. J Nucl Med. 2012;53(7):1091-1101. doihttps://doi.org/10.2967/jnumed.111.098830
31. Hillengass J, Landgren O. Challenges and opportunities of novel imaging techniques in monoclonal plasma cell disorders: imaging “early myeloma”. Leuk Lymphoma. 2013;54(7):1355-1363. doihttps://doi.org/10.3109/10428194.2012.740559
32. Dutoit JC, Verstraete KL. MRI in multiple myeloma: a pictorial review of diagnostic and post-treatment findings. Insights Imaging. 2016;7(4):553-569. doihttps://doi.org/10.1007/s13244-016-0492-7
33. Koh D-M, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR Am J Roentgenol. 2007;188(6):1622-1635. doihttps://doi.org/10.2214/AJR.06.1403
34. Hillengass J, Usmani S, Rajkumar SV, et al. International myeloma working group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019;20(6):e302-e312. doihttps://doi.org/10.1016/S1470-2045(19)30309-2
35. Dimopoulos MA, Hillengass J, Usmani S, et al. Role of magnetic resonance imaging in the management of patients with multiple myeloma: a consensus statement. J Clin Oncol. 2015;33(6):657-664. doihttps://doi.org/10.1200/JCO.2014.57.9961
36. Sachpekidis C, Hillengass J, Goldschmidt H, et al. Comparison of (18)F-FDG PET/CT and PET/MRI in patients with multiple myeloma. Am J Nucl Med Mol Imaging. 2015;5(5):469-478. http://www.ncbi.nlm.nih.gov/pubmed/26550538.
37. Zamagni E, Nanni C, Patriarca F, et al. A prospective comparison of 18F-fluorodeoxyglucose positron emission tomography-computed tomography, magnetic resonance imaging and whole-body planar radiographs in the assessment of bone disease in newly diagnosed multiple myeloma. Haematologica. 2007;92(1):50-55. doihttps://doi.org/10.3324/haematol.10554
38. Swaika A, Advani PP, Ghosh RN, Jha AK, Jiang L, Ailawadhi S. Multiple asymptomatic colon plasmacytomas: a diagnostic and therapeutic dilemma. Ann Hematol. 2015;94(6):1061-1062. doihttps://doi.org/10.1007/s00277-014-2283-x
39. Gutnik SH, Bacon BR. Endoscopic appearance of gastric myeloma. Gastrointest Endosc. 1985;31(4):263-265. doihttps://doi.org/10.1016/S0016-5107(85)72178-5
40. Chantry A, Kazmi M, Barrington S, et al. Guidelines for the use of imaging in the management of patients with myeloma. Br J Haematol. 2017;178(3):380-393. doihttps://doi.org/10.1111/bjh.14827
41. Hillengass J, Usmani S, Rajkumar SV, et al. International myeloma working group consensus recommendations on imaging in monoclonal plasma cell disorders. Lancet Oncol. 2019;20(6):e302-e312. doihttps://doi.org/10.1016/S1470-2045(19)30309-2