Moskva, Russian Federation
Moskva, Russian Federation
UDC 61
CSCSTI 76.29
BISAC MED018000 Diagnosis
BISAC MED062000 Oncology
Introduction. Currently breast cancer is considered a heterogeneous disease and spectrum of several biological subtypes. Ovarian cancer is also characterized by a variety of molecular genetic alterations. Both diseases remain the leading specific causes of death in age group 40-49 and 50-59 for females. Objective: to evaluate the frequency of mutations in the genes BRCA1/2 and CHEK2 in patients with breast cancer and patients with ovarian cancer, as well as in women with benign neoplasms of the mammary glands, and to analyze their clinical and morphological correlations with the disease characteristics in the routine clinical practice of an outpatient oncologist. Patients and Methods: Seventy-six women were included in the present analysis. All of them were observed by the oncologist in Consultative and diagnostic center of Burdenko Main Military Clinical Hospital (Moscow) between January 2016 and May 2019, and were divided in three groups: patients with breast cancer (n=20), patients with ovarian cancer (n=17) and control group of women with benign neoplasms of the mammary glands (fibrocystic mastopathy in 29, breast fibroadenoma in 11), with no history of any oncological disease. One patient has metachronous malignant neoplasms of independent (primary) multiple sites: breast and ovarian cancer. All women were genotyped for pathogenic germline mutations 185delAG, 300T>C (Cyse61Gly), 2080delA, 3819delGTAAA, 3875delGTCT, 4153delA, 5382InsC in the gene BRCA1, mutation 6174delT in the gene BRCA2 and mutations IVS2+1G>A, I157T and IVS2+1G>A in the gene CHEK2 by polymerase chain reaction real-time using a set “OncoGenetics” (LLC «Research and Production Company DNA-Technology», Russia, registration certificate № 2010/08415). Results: Pathogenic germline BRCA1 mutations were identified in 4 (20%) patients with breast cancer, 3 (17,6%) patients with ovarian cancer and 1 (2,5%) women with breast fibroadenoma. Pathogenic germline CHEK2 mutations were identified in 3 (15%) patients with breast cancer, all cases were represented by the I157T mutation. In the control group carriers of BRCA1 or BRCA2 mutations (n=2) were associated with early onset development of breast fibroadenoma in the age before 30 years. The risk of BRCA or CHEK2 mutated genes was significant higher in patients with breast cancer (45%, HR 9.0, 95% CI: 2.14 - 37.8) compared with the control group of women with benign breast tumors (5%, p <0.001). The risk of BRCA or CHEK2 mutations was also higher in patients with ovarian cancer (17.6%, HR 3.53, 95% CI: 0.65 – 19.26) compared with the control group (5%), but the difference did not reach significance (p=0.151). Genotyping BRCA and CHEK2 results were correlated (r = 0.423) with a family history: mutations were more often detected in women with a family history of cancer (42.9% versus 7.3%, p = 0.001). Women with identified mutations showed an increased risk of early onset cancer development before the age of 50 years (69.2%, HR 4.33, 95% CI: 1.64 - 11.36, p = 0.003) compared with wild-type carriers BRCA and CHEK2 genes (16%). The only case of primary multiple metachronous malignant tumors of the breast and ovaries, as well as cases of bilateral breast cancer lesions were detected only among carriers of BRCA1/2 mutations. The prevalence of aggressive high grade cancer was higher in patients with BRCA and CHEK2 mutations (63.6%, HR 2.45, 95% CI: 0.87 - 6.90) than in patients with wild type genes (47.1 %), however, the difference did not reach significance (p = 0.141). Conclusions: Our results have shown the relevance and value of identifying for BRCA- and CHEK2-related breast cancer and ovarian cancer in women in everyday clinical practice. The vast majority of cases of breast and ovarian cancer among carriers of BRCA1/2 and CHEK2 mutations are found in the working and reproductive age of women and are associated with unfavorable disease characteristics - high grade and lower survival.
breast cancer; ovarian cancer; breast fibroadenoma; BRCA; CHEK2; age at diagnosis; grade tumor
Введение
Обследование, лечение и медицинская реабилитация при злокачественных новообразованиях (ЗНО) являются социально значимыми видами медицинской деятельности [1]. Наибольший удельный вес в современной структуре онкологической заболеваемости женского населения в России имеют ЗНО органов репродуктивной системы (39,2%) - рак молочной железы (РМЖ) и рак яичников (РЯ) занимают соответственно 1-е и 5-е место как по заболеваемости, так и среди онкологической смертности у женщин [2]. РМЖ и РЯ являются основными причинами смерти у женщин в возрасте 40-49 и 50-59 лет.
Согласно современным взглядам, РМЖ не является единообразным заболеванием и включает несколько биологических подтипов, которые могут быть надежно определены с использованием методов генетического тестирования или иммуногистохимического анализа (ИГХ). Более того, подходы к планированию терапии уже основаны на четком распознавании биологических подтипов, а рекомендации по системной противоопухолевой терапии сегодня определяются молекулярной классификацией РМЖ [3]. РЯ также характеризуется разнообразием молекулярно-генетических нарушений, которые коррелируют с клиническими и морфологическими данными [4-5].
В ряде случаев (до 20%) РМЖ и РЯ предстают как наследственное заболевание, связанное с ролью генов BRCA1 и BRCA2 (breast cancer 1 и breast cancer 2 - гены, ассоциированные с раком молочной железы). Впервые эти гены были открыты в США в 1994 году, участвуют в процессе восстановления молекулы ДНК при двунитевых разрывах (поддержание стабильности генома) и функционально относятся к генам-онкосупрессорам. BRCA-ассоциированный риск развития опухоли наследуется по аутосомно-доминантному принципу от одного из родителей, который передает наследуемый (герминальный) мутантный вариант гена.
Аналогичное значение имеют герминальные мутации в гене CHEK2 (checkpoint kinase 2 - протеинкиназа контрольной точки 2 типа), который также относится к генам-онкосупрессорам и участвует в регуляции клеточного цикла при двунитевых повреждениях ДНК. Функция белка Chk2 тесно связана с белком BRCA1, p53 и другими онкосупрессорными молекулами. Несмотря на существование других генов-онкосупрессоров (PTEN, ATM, TP53), наиболее востребованной и значимой на сегодняшний день остается генетическое тестирование BRCA1/2 и CHEK2 с целью выявления наследственной предрасположенности к РМЖ и РЯ.
Описано около 200 мутаций в– генах BRCA, биологический смысл существенной части (≥38%) из них остается неизученным и не может быть рекомендован для клинического обследования [6]. Благодаря исследованиям российских ученых, определен набор герминальных мутаций в генах BRCA1/2 и CHEK2, наиболее распространенных в российской популяции и имеющих доказанную клиническую значимость [7].
Цель исследования: оценить частоту распространенности мутаций в генах BRCA1/2 и CHEK2 у больных РМЖ и РЯ, а также в популяции женщин, страдающих доброкачественными новообразованиями молочных желез, и проанализировать их клинико-морфологические корреляции с характеристиками заболеваний в рутинной клинической практике врача-онколога амбулаторного звена.
Материалы и методы.
В исследование были включены 76 женщин, наблюдающихся у онколога КДЦ ГВКГ им. академика Н.Н. Бурденко (г. Москва) на протяжении 2016 – 2019 годов, которые были разделены на три группы. У всех женщин было получено письменное информированное согласие об участии в исследовании (обязательный критерий включения), дизайн исследования был одобрен Локальным этическим комитетом ФГБУ «ГВКГ им. академика Н.Н. Бурденко».
Первые две группы составили больные, страдающие РМЖ (n=20) и РЯ (n=17), средний возраст у которых на момент манифестации заболеваний был 49,5 ± 12,2 лет (диапазон 23 – 69 лет) и 58,2 ± 12,1 лет (диапазон 31 – 80 лет) соответственно. Диагноз у всех пациенток был гистологически подтвержден, степень злокачественности опухоли определялась согласно критериям Ноттингемской классификации в модификации по Элстону и Эллису (для РМЖ) [8] и Международной гистологической классификации ВОЗ (для РЯ) [9]. Статус рецепторов эстрогенов и прогестерона, Her2/neu и индекса Ki-67 в опухоли определяли с использованием стандартных методов иммуногистохимического анализа. У одной женщин был первично-множественный метахронный рак молочной железы и яичников.
В контрольную группу были включены 40 женщин с доброкачественными новообразованиями молочных железы (фиброзно-кистозной мастопатией: n=29, фиброаденомой: n=11), не имеющие в анамнезе перенесенные онкологические заболевания какой-либо локализации (критерий исключения). Средний возраст женщин в этой группе на момент проведения исследования составил 49,1 ± 14,4 лет (диапазон 22 – 73 лет).
Во всех трех группах была проведена ДНК-диагностика герминальных патогенных мутаций 185delAG, 300T>C (Cyse61Gly), 2080delA, 3819delGTAAA, 3875delGTCT, 4153delA, 5382InsC в гене BRCA1, мутации 6174delT в гене BRCA2 и мутаций IVS2+1G>A, I157T и IVS2+1G>A в гене CHEK2 с использованием метода полимеразной цепной реакции (ПЦР) в режиме реального времени (набор реагентов ОнкоГенетика, компании ДНК-Технология, Россия; регистрационное удостоверение МЗ СР РФ №ФСР 2010/08415). Диагностическая чувствительность данного метода составляет 100% (95% доверительный интервал (ДИ): 93,9-100%), диагностическая специфичность – 100% (95% ДИ: 99,6-100%) Материалом для генотипирования служила ДНК, выделенная из клеточных ядер лимфоцитов периферической крови обследуемых. В случае обнаружения мутации дополнительным методом подтверждения было проведение секвенирования ДНК кодирующей части указанных генов. Молекулярная диагностика выполнялась на базе четырех лабораторий: в лаборатории эпигенетики ФГБНУ «Медико-генетический научный центр», в Центре молекулярной диагностики CMD Центрального НИИ Эпидемиологии и в медицинской лаборатории «Гемотест».
Статистическую обработку материалов исследования проводили с помощью пакета специализированных прикладных программ SPSS Statistics (IBM Corp., США) версии 22. Для нахождения различий между качественными показателями у обследованных женщин различных групп применяли точный критерий Фишера. Для оценки различий числовых данных в группах при нормальном виде распределения применяли метод параметрической статистики (t-критерий Стьюдента), при отсутствии нормального распределения данных использовали методы непараметрической статистики (U-тест Манна–Уитни). Статистически значимыми считали различия при р <0,05 (95 % уровень значимости).
Результаты
При генотипировании BRCA1 76 обследуемых стандартным методом значимые мутации выявлены у 7 (9,2%) женщин – 4 (20%) больных РМЖ, 3 (17,6%) больных РЯ и у 1 (2,5%) женщины с фиброаденомой молочной железы. Среди носителей мутантного гена BRCA1 была пациентка с первично-множественными метахронными злокачественными новообразованиями молочной железы и яичников. Наиболее распространенной была мутация 5382insC в гетерозиготном состоянии (5/7, 71,4%), реже обнаруживались «делеторные» мутации 3875delGTCT и 2080delA в гетерозиготном состоянии (по одному случаю, 14,3%).
Мутации в гене BRCA2 были обнаружены у 3 (3,9%) женщин – 2 (10%) в группе РМЖ и 1 (2,5%) с фиброаденоматозом молочных желез. В группе больных РЯ не отмечено случаев наследования мутации 6174delT.
Мутации в гене CHEK2 были выявлены у 3 (4%) женщин и только в группе больных РМЖ (15%). Все случаи были представлены мутацией I157T в 4 экзоне гена CHEK2 в гетерозиготном состоянии.
В контрольной группе женщин с доброкачественными новообразованиями все случаи мутаций BRCA1 и BRCA2 (n=2) были ассоциированы с развитием фиброаденомы молочных желез в молодом возрасте до 30 лет. Случаев мутаций у женщин с фиброзно-кистозной мастопатией не обнаружено.
Риск носительства мутаций в генах BRCA и CHEK2 оказался значимо выше в группе больных раком молочной железы (45%, ОР 9,0, 95% ДИ: 2,14 – 37,8) по сравнению с контрольной группой женщин с доброкачественными новообразованиями молочных желез (5%, p < 0,001). В то же время в группе больных раком яичников риск носительства мутаций был также выше (17,6%, ОР 3,53, 95% ДИ: 0,65 – 19,26), чем в контрольной группе (5%), но различие не достигло достоверных различий (p = 0,151).
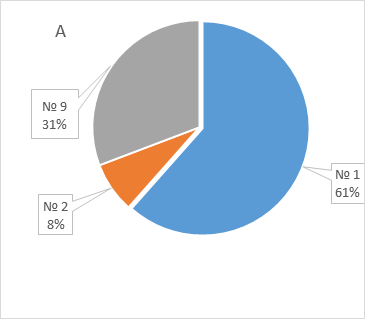
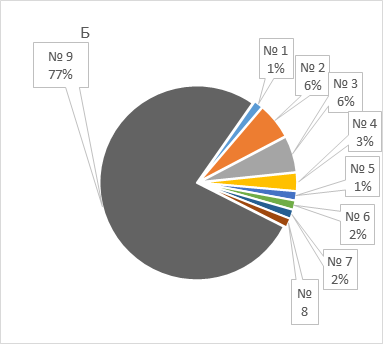
Результаты генотипирования BRCA и CHEK2 прямо коррелировали (r = 0,423) с семейным анамнезом: мутации чаще выявлялись у женщин с семейной отягощенностью онкологическими заболеваниями (42,9%), чем у женщин, чьи родственники не страдали онкологическими болезнями (7,3%). Риск выявления мутаций был значимо выше при наличии положительного семейного анамнеза (ОР 5,88, 95% ДИ: 2,03 – 17,24, p = 0,001), чем при отсутствии анамнеза. Обнаружены существенные различия и в структуре семейной отягощенности в зависимости от результатов генотипирования (рисунок 1): у носителей мутаций чаще преобладал семейный анамнез РМЖ и РЯ, в то время как для носителей дикого типа был характерным анамнез других онкологических заболеваний (преимущественно, рака легкого).
|
№ 1 |
Рак молочной железы Breast Cancer |
№ 4 |
Гепатоцеллюлярная карцинома Hepatocellular Carcinoma |
№ 7 |
Рак почки Kidney Cancer |
|
№ 2 |
Рак яичников Ovarian Cancer |
№ 5 |
Рак толстой кишки Colon Cancer |
№ 8 |
Рак мочевого пузыря Bladder Cancer[DK1] |
|
№ 3 |
Немелкоклеточный рак легкого Non-Small Cell Lung Cancer |
№ 6 |
Рак тела матки Uterine Neoplasms |
№ 9 |
Отсутствует None |
Рисунок 1. Сравнительная характеристика структуры семейной отягощенности онкологическими заболеваниями у женщин с мутациями (А) и диким типом (Б) генов BRCA и CHEK2.
Figure 1. Comparison of the family history of cancer in women patients with mutated (A) and wild type (Б) BRCA and/or CHEK2 genes.
Средний возраст манифестации РМЖ и РЯ оказался значимо более молодым у носителей мутаций в генах BRCA и CHEK2 (44,4 ± 15,0 лет, диапазон 23 – 69 лет), чем у женщин без выявленных мутаций (56,9 ± 11,0 лет, диапазон 26 – 80 лет, p = 0,015). У пациенток с мутантными генами BRCA и CHEK2 средний возраст манифестации РМЖ был 42,4 ± 14,6 лет, возраст манифестации РЯ – 47,0 ± 18,7 лет. Сравнение возраста выявления РМЖ и РЯ в зависимости от генотипа BRCA и CHEK2 представлено на рисунке 2.
У женщин с выявленными мутациями наблюдался повышенный риск раннего развития онкологических заболеваний в возрасте до 50 лет (69,2%, ОР 4,33, 95% ДИ: 1,64 – 11,36, p = 0,003) по сравнению с носителями дикого типа генов BRCA и CHEK2 (16%).
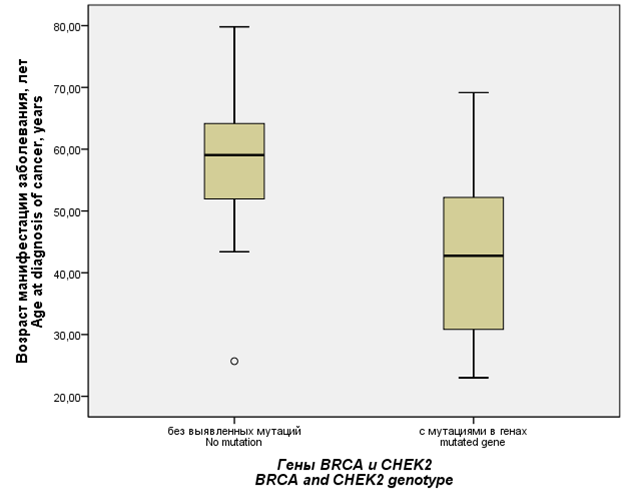
Рисунок 2. Возраст манифестации онкологических заболеваний (рака молочной железы и рака яичников) у женщин в зависимости от результатов генотипирования BRCA и CHEK2.
Figure 2. Age at diagnosis of oncological diseases (breast cancer and ovarian cancer) in women by BRCA and CHEK2 genotype.
Единственный случай первично-множественных метахронных злокачественных опухолей молочной железы и яичников был ассоциирован с носительством мутации в гене BRCA1. Риск билатерального опухолевого поражения молочных желез наблюдался только у женщин с выявленными мутациями в гене BRCA2 и не обнаруживался у пациенток с диким типом BRCA/CHEK2.
Частота распространенности форм опухоли с высокой степенью злокачественности была выше среди больных с мутациями BRCA и CHEK2 (63,6%, ОР 2,45, 95% ДИ: 0,87 – 6,90), чем с диким типом генов (47,1%), однако различие не достигло достоверной значимости (p = 0,141). Случаи гормон-рецептор-негативных опухолей молочных желез наблюдались вне зависимости от генотипа BRCA и CHEK2: с одинаковой частотой отмечены в группе носителей мутаций (11,1%, случай «трижды негативного» РМЖ у больной с мутацией 5382insC в гене BRCA1) и в группе носителей дикого типа генов (9,1%).
Обсуждение результатов
По результатам нашей работы можно сделать целый ряд выводов, имеющих важное практическое значение.
Во-первых, в нашей работе обнаружена высокая распространенность мутаций в генах BRCA и CHEK2 при рутинном обследовании группы больных РМЖ и РЯ, в отличие от женщин с доброкачественными новообразованиями молочных желез. Известно, что распространенность мутаций генов BRCA1/2 в популяции здорового населения сильно различается в зависимости от исследуемой этнической группы (от 1/40 до 1/1000 в Северной Америке) [10-11]. Ранее проведенные российские исследования наглядно демонстрируют генетическую неоднородность РМЖ и РЯ с превалированием мутаций в генах BRCA1/2 (от 23% при РЯ до 33% при РМЖ) и CHEK2 (до 5% при РЯ) [4, 7]. Преобладают мутации 5382insC в гене BRCA1 и мутации I157T в гене CHEK2, что полностью совпадает с данными нашего наблюдения.
Во-вторых, как показало наше исследование, вероятность обнаружения мутаций существенно возрастала (в 5 раз) при наличии семейной отягощенности онкологическими заболеваниями. Прицельный опрос женщин об онкологической заболеваемости у их кровных родственников может служить эффективным маркером для принятия решения о целесообразности генетического тестирования.
В-третьих, нами убедительно продемонстрирована связь между носительством мутаций и ранним началом заболеваний (в возрасте до 50 лет). По нашим данным, средний возраст манифестации РМЖ и РЯ у носителей мутаций составил 42,4 и 47,0 лет, в то время как у женщин без мутаций составил 56,9 лет. Для сравнения: по данным Минздрава России, средний возраст впервые установленного диагноза в 2017 году был 61,4 лет (для РМЖ) и 59,3 лет (для РЯ) [12]. Таким образом, тактика лечения РМЖ и РЯ существенно отличается в зависимости от генотипа BRCA и CHEK2: среди носителей мутаций очевидно будет более востребованным и значимым сохранение репродуктивного здоровья и восстановление трудоспособности, чем у женщин без мутаций.
В нашем исследовании обнаружена группа повышенного риска - у 2 женщин с выявленными мутациями BRCA в возрасте моложе 30 лет обнаружены фиброаденомы молочной железы, что требует регулярного проведения профилактического обследования. По данным исследований The Breast Cancer Linkage Consortium [13], накопленный риск развития РМЖ для носителей мутаций в генах BRCA1/2 к 80 годам достигает 80–85 %, в гене CHEK2 — 37 %.
И, наконец, в-четвертых, наше наблюдение показывает, что наличие BRCA- и СHEK2-ассоциированных РМЖ и РЯ сопряжено с неблагоприятными характеристиками онкологических заболеваний – преобладанием опухолевых форм с высокой степенью злокачественности, метахронным поражением яичников/молочных желез и риском двухстороннего поражения органов. По данным Eerola и соавт., гормон-рецептор-негативный статус опухолей (к эстрогену, прогрестерону) и Her2/neu-негативный статус также чаще обнаруживаются у больных с мутациями в генах BRCA1 и BRCA2 [14]. В нашем наблюдении мы отметили случай «трижды негативного» РМЖ у носителя мутации в гене BRCA1. Случаи первично-множественного метахронного рака и билатеральных опухолей были зарегистрированы только у женщин с мутациями в генах BRCA1/2.
К аналогичным выводам приходят и зарубежные исследователи: по данным Robson и соавт., 5-летний риск развития рака контрлатеральной РМЖ у женщин, заболевших до 42 лет, достигает 31% [15], по данным Graeser M.K., кумулятивный риск развития контрлатерального РМЖ в течение 25 лет после установления первичного диагноза РМЖ у носителей мутаций достигает 47,4%, причем оказывается еще в 1,6 раза выше при мутации в гене BRCA1. Обнаружена закономерность: в случае манифестации первичного РМЖ у носителя мутации в возрасте до 40 лет, 25-летний риск контрлатерального РМЖ составляет уже 62,9% и не превышает 20% в случае первичного заболевания, установленного после 50 лет [16].
Согласно современным представлениям, не только РМЖ и РЯ связаны с генотипом BRCA и CHEK2, но и ряд других онкологических заболеваний (табл. 1), причем как у женщин, так и у мужчин [17-18]. Для мужчин предложен риск-ориентированный подход к ПСА-скринингу, учитывающий семейный анамнез РМЖ и РЯ, рака предстательной железы (РПЖ) и поджелудочной железы [17].
Таблица 1. Синдромы, ассоциированные с наследственным раком молочной железы [18-19].
Table 1. Various syndromes associated with hereditary breast cancer [18-19]
|
Синдром Syndrome |
Гены Gene |
Клинические проявления Clinical manifestation |
|
Синдром наследственного рака молочной железы и/или яичников Hereditary Breast and Ovarian Cancer syndrome |
BRCA1, BRCA2 |
РМЖ, РЯ, рак предстательной железы, рак поджелудочной железы, меланома, рак толстой кишки Breast Cancer. Ovarian Cancer. Prostate Cancer. Pancreatic Adenocarcinoma. Melanoma. Colon Cancer |
|
Синдром Ли-Фраумени Li-Fraumeni syndrome |
CHEK2, TP53 |
РМЖ, мягкотканные саркомы, остеосаркомы, опухоли головного мозга, рак щитовидной железы, лейкозы, адренокортикальный рак Breast Cancer. Soft Tissue Sarcoma. Osteosarcoma. Brain Tumor. Thyroid Carcinoma. Hodgkin Lymphoma. Adrenocortical Carcinoma |
|
Синдром Луи-Бар Louis-Bar syndrome |
ATM |
Лимфома, мозжечковая атаксия, глиома головного мозга, поражения кожи, иммунодефицит, медуллобластома, РМЖ Lymphoma. Cerebellar atrophy with ataxia. Glioma. Cutaneous telangiectasias. Immune deficiency. Medulloblastoma. Breast Cancer |
|
Синдром Линча (наследственный неполипозный рак толстой кишки) Lynch syndrome (often called Hereditary Nonpolyposis Colorectal Cancer) |
MSH2, MSH3, MSH6, MLH1, PMS1, PMS2 |
Рак толстой кишки, первично-множественные злокачественные опухоли: рак тела матки, яичников, молочной железы, желудка, тонкой кишки, мочеточника/почечной лоханки, желчных путей; сочетание с опухолями головного мозга (синдром Тюрко) или множественными аденомами сальных желез (синдром Торре) Colon Cancer, Malignant neoplasms of independent (primary) multiple sites: Uterine Cancer, Ovarian Cancer, Breast Cancer, Stomach Cancer, Small Bowel Adenocarcinoma, Upper Urinary Tract Cancer, Bile Duct Cancer; Turcot syndrome (formation of multiple benign polyps in the colon that occur in association with a primary Brain Tumor). Muir-Torre syndrome (Colon Cancer in association with Sebaceous (oil gland) Skin tumors) |
|
Наследственный диффузный рак Hereditary Diffuse Gastric Cancer syndrome |
CDH1 |
Рак желудка, дольковый РМЖ Stomach Cancer. Lobular Breast Cancer |
|
Синдром Пейтца-Егерса Peutz-Jeghers syndrome |
STK11 |
Пигментация кожи, слизистых оболочек ротовой полости, множественные гамартомы ЖКТ, РМЖ, герминогенные опухоли Hyperpigmented macules on the skin and oral mucosa (melanosis). Multiple hamartomatous polyps in the gastrointestinal tract. Breast Cancer. Germ Cell Tumors |
|
Синдром Коудена (синдром множественных гамартом) Cowden syndrome (often called Multiple Hamartoma Syndrome) |
PTEN |
Поражение слизистых оболочек и кожи, множественные гамартомы (преимущественно в ЖКТ), РМЖ, рак щитовидной железы, опухоли матки Characteristic lesions on the mucosa and skin. Multiple hamartomas in the gastrointestinal tract. Breast Cancer. Thyroid Carcinoma. Uterine Neoplasms |
|
Анемия Фанкони Fanconi anemia |
BRIP/FANCJ, PALB2/FANCN, FANCA |
Апластическая анемия, аномалии костей скелета, неврологические нарушения, врожденные пороки сердца, РМЖ Aplastic anemia. Skeletal abnormalities. Neurological disorders. Congenital defects of the heart. Breast Cancer |
|
Синдром хромосомной нестабильности Chromosome fragility syndrome (often called The Nijmegen Breakage Syndrome)
|
NBS1 |
Микроцефалия, первичный иммунодефицит, повышенная чувствительность к радиоактивному излучению, РМЖ Microcephaly. Primary immune deficiency. Hypersensitivity to radiation. Breast cancer |
Заключение
Полученные нами результаты свидетельствуют об актуальности и значимости выявления в рутинной клинической практике BRCA- и CHEK2-ассоциированных форм заболеваний у женщин с РМЖ и РЯ. Подавляющее большинство случаев заболеваний у носителей мутаций в генах BRCA1/2 и CHEK2 обнаруживается в трудоспособном и репродуктивном возрасте женщин и сопряжены с неблагоприятными характеристиками – высокой степенью злокачественности и меньшей выживаемостью.
1. Krykov EV, Chaplyuk AL, Koryakin SV et al. General approaches to the formulation of the diagnosis of malignant neoplasm in the conduct of military medical examination. Voenno-meditsinskii jurnal [Military Medical Journal]. 2017;338(12):13-17 (In Russ.).
2. Zaridze DG, Kaprin AD, Stilidi IS Dynamics of morbidity and mortality from malignant tumors in Russia. J Voprosy onkologii [Problems in oncology]. 2018;64(5):578-591 (In Russ.).
3. Semiglazov VF. Strategy of treatment for breast cancer based on biological subtypes’ identification. J Voprosy onkologii [Problems in oncology]. 2011;57(5):542-552 (In Russ.).
4. Bateneva YI, Filippova MG, Tyulyandina AS et al. High rate of mutations in the BRCA1, BRCA2, CHEK2, NBN, and BLM genes in Russian ovarian cancer patients. J Opuholi ženskoj reproduktivnoj sistemy [Tumors of female reproductive system]. 2014;(4):51-56. (In Russ.). doi:https://doi.org/10.17650/1994-4098-2014-0-4-51-56
5. Grigoruk OG, Pupkova EE, Bazulina LM, Lazarev AF. Serous ovarian carcinoma. Cytological and immunocytochemical and molecular genetic diagnostics. J Opuholi ženskoj reproduktivnoj sistemy [Tumors of female reproductive system]. 2016;12(2):70-76. (In Russ.). doi:https://doi.org/10.17650/1994-4098-2016-12-2-70-76
6. Shattuck-Eidens D, Oliphant A, McClure M et al. BRCA1 sequence analysis in women at high risk for susceptibility mutations. Risk factor analysis and implications for genetic testing. JAMA 1997;278(15):1242-1250. PMID: 9333265.
7. Bateneva EI, Meshcheryakov AA, Lyubchenko LN et al. Frequencies of eleven BRCA1 and BRCA2 mutations in random sample of russian breast cancer patients. Uralsky meditsinsky jurnal [Ural Medical Journal] 2011;3(81):69-73. (In Russ.).
8. Christgen M, Länger F, Kreipe H. Histological grading of breast cancer. Pathologe. 2016;37(4):328-36. (In Germ.). doi:https://doi.org/10.1007/s00292-016-0182-8
9. Kurman RJ, Carcangiu ML, Herrington CS, Young RH WHO classification of tumours of female reproductive organs, 4th ed. IARC, Lyon, 2014.
10. Nelson HD, Pappas M, Cantor A et al. Risk Assessment, Genetic counseling, and genetic testing for BRCA-related cancer in women: updated evidence report and systematic review for the US Preventive Services Task Force. JAMA. 2019;322(7):666-685. doi:https://doi.org/10.1001/jama.2019.8430.
11. Tang EY, Trivedi MS, Kukafka R et al Population-based study of attitudes toward BRCA genetic testing among Orthodox Jewish women. Breast J. 2017;23(3):333-337. DOI:https://doi.org/10.1111/tbj.12736.
12. Kaprin AD,. Starinskiy VV, Petrova GV. Malignant tumors in Russia in 2017 (morbidity and mortality). Moscow: MNIOI im. P.A. Gertsena - filial FGBU “NMIRTS” Minzdrava Rossii, 2018. 250 p. (In Russ.).
13. Ford D, Easton DF, Stratton MR et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. Am J Hum Gen 1998;62(3):676-89. doi:https://doi.org/10.1086/301749. PMID: 9497246.
14. Eerola H, Heinonen M, Heikkilä P et al. Basal cytokeratins in breast tumours among BRCA1, BRCA2 and mutation-negative breast cancer families. Breast Cancer Res 2008;10(1):17
15. Robson M, Levin D, Federici M et al. Breast conservation therapy for invasive breast cancer in Ashkenazi women with BRCA gene founder mutations. J Natl Cancer Inst 1999;91(24):2112 7. doi:https://doi.org/10.1093/jnci/91.24.2112. PMID: 10601383.
16. Graeser MK, Engel C, Rhiem K et al. Contralateral breast cancer risk in BRCA1 and BRCA2 mutation carriers. J Clin Oncol 2009;27(35):5887 5892. doi:https://doi.org/10.1200/JCO.2008.19.9430. PMID: 19858402.
17. Kirichek AA, Lyubchenko LN, Matveev VB. Risk-adapted approach to prostate cancer screening. Onkourologiya [Cancer Urology]. 2018;14(2):109-121. (In Russ.). doi:https://doi.org/10.17650/1726-9776-2018-14-2-109-121
18. Kopnin BP. Tumor suppressor and mutated genes. In: Zaridze DG. Tumorigenesis. Moscow: Medicina, 2004:125-126. (In Russ.).
19. Imyanitov EN. Molecular diagnosis in oncology. Moleculyarnaya biologiya [Molecular Biology]. 2008;42(5):687-698. (In Russ.).