Moskva, Russian Federation
Moscow State University of Food Production (Surgery Dept, Medical Institute of Continuing Education, Professor)
Moskva, Moscow, Russian Federation
Haass Moscow Medical and Social Institute, Moscow, Russian Federation (Dept of Preventive Medicine, Head,MD)
Haass Moscow Medical and Social Institute, Moscow, Russian Federation (Dept of Internal Diseases, Professor)
Moskva, Moscow, Russian Federation
Moskva, Moscow, Russian Federation
Moscow State University of Food Production
Moskva, Moscow, Russian Federation
Moskva, Russian Federation
VAK Russia 14.02.2002
UDC 61
CSCSTI 76.29
CSCSTI 76.35
Russian Library and Bibliographic Classification 526
Russian Library and Bibliographic Classification 53
Russian Library and Bibliographic Classification 56
Russian Trade and Bibliographic Classification 5708
Russian Trade and Bibliographic Classification 5716
Russian Trade and Bibliographic Classification 573
BISAC MED028000 Epidemiology
BISAC MED085010 Surgery / Neurosurgery
Importance. Healthcare-associated infectionsare an important issue in the neurosurgery. The changes in the epidemiological structure of etiological agents, the increase of antimicrobial drug resistance may lead to the ineffectiveness of previously used patterns for the prevention and treatment of healthcare-associated infections. Objective.The aim of the research was to study the microbiological structure of leading etiological agents that cause healthcare-associated infectionsin patients of neurosurgery intensive care unitand to evaluate the effectiveness of the most used antibacterial drugs. Patients and Methods.A retrospective statistical analysis of the results of microbiological monitoring of pathogens of healthcare-associated infectionsin patients of neurosurgery intensive care unitin 2013-2017 was carried out. Results. The share of gram-negative microorganisms among all isolated microorganisms in the period 2013-2017 increased from 42.47% in 2013 to 54.10% and 50.68% in 2016 and 2017.K. pneumoniae, A. baumannii, P. aeruginosa were most often isolated among gram-negative pathogens, and S. aureus, E. faecalis, and S. Epidermidis- amonggram-positive pathogens; the total rate of these six microorganisms progressively increased from 58.91 % in 2013 to 80.51% in 2017. The rateof A. baumanniiincreased from 8.22% in 2013 to 15.58% in 2017 and the rate of K. pneumoniae- from 5.48% in 2013 to 14.29% in 2017, stable significant detectability of P. aeruginosatended to increase (from 9, 59% in 2013 to 11.69% in 2017). Enterococcus spp. was identified at a significantly high level, mainly E. faecalis and E. faeciumwere represented. E. faecalis dominated (10.96% in 2013, 12.35% in 2014, 10.24% in 2015, 8.70% in 2016, 6.49% in 2017) among the isolated Enterococcus spp. A dynamic decrease in the antimicrobial activity of most used antibacterial drugs was revealed. The greatest dynamic decrease in antimicrobial activity was observed in the aminoglycoside antibiotics - gentamicin and amikacin; amoxicillin / clavulanic acid and levofloxacin. The sensitivity to vancomycin and linezolidremained at levels close to 100%. Conclusions.Today recommendations for perioperative antibiotic prophylaxis with cefazolin remain relevant. When conducting empirical antibacterial therapy, it is justified to use a combination of vancomycin with the IIId generation cephalosporins until the results of a microbiological study are obtained. An increase in the rate of resistant microorganisms complicates antibacterial therapy, requires the usage of several antibacterial drugs and increase the importance of preventive actions.
Healthcare-associated infections, Hospital acquiredinfections, Nosocomial infections, Intensive care infections, Cross-infections, Neurosurgery, Microbiological analysis, Microbial sensitivitytests, Anti-bacterial drugs, Anti-bacterial drug resistance, Anti-microbial activity
Списоксокращений
ESBL - Extended Spectrum β-Lactamases;
MRS - methicillin-resistant staphylococci;
БЛРС - β-лактамазырасширенногоспектра;
ВБИ - внутрибольничные инфекции;
ВП – внутрибольничные пневмонии;
ИМП – инфекции мочевыводящих путей;
ИСМП – инфекции, связанные с оказанием медицинской помощи;
КАИК - катетер-ассоциированные инфекции кровотока;
МРС - метициллин-резистентностьстафилококков;
ОРИТ – отделение реанимации и интенсивной терапии
Введение
Оказание медицинской помощи сопряжено с риском возникновения нежелательных событий и последствий для здоровья пациентов. Всемирный альянс за безопасность пациентов указывает, что по данным исследований в разных странах вред пациенту в стационарных условиях причиняется в 4-16,6%, при этом летальный исход может наступать у 14% таких пациентов[1], и,по мнению некоторых авторов, развитие этих нежелательных событий можно было предотвратить. К нежелательным событиям для пациентов относятся и развитие инфекций, связанных с оказанием медицинской помощи – эквивалент применяемого в англоязычной литературе термина Healthcareassociatedinfections[2–4], ставшего предметом внимания первой двухлетней инициативы Всемирного альянса за безопасность пациентов в 2005-2006[1]. В России в это собирательное понятие входят и внутрибольничные инфекции (ВБИ)[1]. По данным исследований, в зависимости от реализации различных факторов риска и проводимых профилактических мероприятий, распространенность ИСМП может составлять от 0,1 до 290 на 1000 пациентов. При этом, частота инфекций области хирургического вмешательства составляет до 118 случаев на 1000 оперированных пациентов, катетер-ассоциированные инфекции кровотока(КАИК) до 12,2 на 1000 дней катетеризации центральных сосудов, инфекций мочевыводящих путей (ИМП) до 8,8 на 1000 дней катетеризации и вентилятор-ассоциированных пневмоний – до 23,9 на 1000 дней искусственной вентиляции лёгких[5–7].
По данным официальной статистики, в Российской Федерации ежегодно регистрируется до 30 тыс. случаев ИСМП (≈ 0,8 случая на 1 000 пациентов). В течение последних 10 лет количество зарегистрированных случаев ИСМП имело тенденцию к снижению, однако, в 2018 отмечено увеличение числа зарегистрированных случаев в сравнении с предыдущим годом на 17,9%. Всего в 2018 зарегистрированы 27071 случай ИСМП (2017 – 22963случая). В 2018 возросла значимость заболеваемости ИСМП в хирургических стационарах, где зарегистрировано 43,3% от всех случаев ИСМП (в 2017 – 35,6%). В структуре зарегистрированных в 2018 ИСМП на первое ранговое место вышли внутрибольничные пневмонии (ВП), которые составили в 2018– 31,1% от общего числа зарегистрированных случаев ИСМП, при этом отмечается их прогрессивное динамическое увеличение 2012 - 13,4%, 2013 - 15,7%, 2014 - 18,7%, 2015 - 21,3%, 2016 - 24,1%, 2017 - 26,3%). Второе место занимают послеоперационные инфекции – 22% (в 2017– 22,9%), доля инфекций мочевыводящих путей (ИМП) в структуре заболеваемости в 2018 составила 8,1% (в 2017 – 2,9%), но вероятно, это связано с улучшением регистрации ИМП[8].
Низкий уровень заболеваемости ИСМП, официально регистрируемый в РФ и некоторых странах бывшего СССР, по сравнению с зарубежными развитыми странами, свидетельствует, по всей видимости, не о благополучной эпидемиологической обстановке, а о дефектах в регистрации заболеваемости пациентов [9–12].
ИСМП являются актуальной проблемой и при лечении пациентов нейрохирургического профиля. Нахождение пациентов в ОРИТ нейрохирургического профиля увеличивает вероятность возникновения ИСМП в 2 раза по сравнению с обычными коечными отделениями [13], вероятность развития ИСМП зависит от длительности предшествующей госпитализации, длительности нахождения в ОРИТ (длительность более 48 часов ассоциируется с большим увеличением риска до трехкратного увеличения риска), количества перенесенных оперативных вмешательств и медицинских манипуляций (венозные катетеры, уретральные катетеры), применения ИВЛ и ее длительности, использования антибактериальной терапии, наличия сопутствующих заболеваний, особенно сахарного диабета [14–19].
В структуре возникающих инфекционных осложнений у пациентов нейрохирургического профиля наиболее часто регистрируются пневмония, инфекции мочевыводящих путей и инфекции области хирургического вмешательства, в том числе менингиты, энцефалиты и вентрикулиты [9,17,18,20–23].
В структуре этиологических агентов, ответственных за клинические проявления внутрибольничных инфекций у пациентов нейрохирургического профиля, наиболее часто встречаются грамположительные микроорганизмы – Staphylococcus aureus и коагулазонегативные стафилококки (чаще всего Staphylococcus epidermidis), и грамотрицательные микроорганизмы, представленные в основном Pseudomonas aeruginosa и Acinetobacter baumannii[18,21,23–25].
Антибиотикорезистентность микроорганизмов приобрела в последнее десятилетие массовый характер, ограничивая возможности антибиотикотерапии, в первую очередь, при ИСМП. Энтеробактерии-продуценты β-лактамаз расширенного спектра действия (БЛРС) (Extended Spectrum β-Lactamases –ESBL) являются существенной проблемой антибиотикотерапии. Продукция БЛРС - один из наиболее распространенных и клинически значимых механизмов резистентности энтеробактерий к современным β-лактамным антибиотикам. Микроорганизмы - продуценты БЛРС способны не только эффективно нейтрализовать действие ряда антибактериальных препаратов (пенициллины, цефалоспорины, азтреонам), но и способны быстро распространять гены резистентности внутри семейства.
Отмечается динамический рост распространенности метициллин-резистентных штаммовStaphylococcuss spp. (МРС)(methicillin-resistant staphylococci - MRS), в том числе Staphylococcus aureus (methicillin-resistant S. aureus- MRSA), коагулазонегативные стафилококки S. epidermidis, S. saprophyticus и другие (в англоязычной литературе - methicillin-resistantcoagulase-negative staphylococci - MRCoNS). Наличие пенициллин-связывающего белка обеспечивает этим микроорганизмам устойчивость к метициллину и оксациллину.
С увеличением длительности госпитализации возрастают риски колонизации несколькими видами микроорганизмов с множественной резистентностью к антибактериальным препаратам.
Цельюисследования явилось изучение структуры и динамики изменений микробного пейзажа патогенов, вызывающих инфекции, связанные с оказанием медицинской помощи у больных в ОРИТ нейрохирургического центра; оценка динамики антимикробной активности применяемых антибактериальных препаратов.
Пациенты и методы
В целях установления ведущих патогенов, которые изолируются изклинически значимых областей интересов при подозрении на ИСМП или высоком риске развития ИСМП, проведён ретроспективный анализ результатов 1077 микробиологических исследованийу 655 больных, проходивших лечение в ОРИТнейрохирургического центра в 2013-2017. Фактическая коечная емкость ОРИТ на период исследования была неизменной и составляла 5 коек, расположенных в общем реанимационном зале, всего проходило лечение 1742 пациента.
Забор биоматериала из соответствующих локусов проводился при развитии клинической картины инфекционных осложнений (развитие стойкой гипертермии до фебрильных цифр, появление аускультативной и/или рентгенологической картины пневмонии, появлении менингеального синдрома, признаков воспаления по данным клинического анализа крови (лейкоцитоз, маркеры воспаления), анализов мочи и др.), а так же при высоком риске развития осложнений (нахождение в ОРИТ более 2суток, длительная ИВЛ, уретральныйкатетер)и стойком субфебрилитете.
Микробиологические исследования выполнялись в бактериологической лаборатории ГВКГ им. Н.Н. Бурденко, аккредитованной на проведение работ с микроорганизмами 3-4 групп патогенности.
Отбор проб биологического материала осуществлялся в соответствии с правилами, изложенными в методических указаниях МУ 4.2.2039-05«Техника сбора и транспортирования биоматериалов в микробиологические лаборатории»[2].
Для биохимической идентификации использовались тест-системы (карты) производства BioMerieux к анализатору VITEK2 Compact (BioMerieux, Франция)[3], позволяющих оценить утилизацию углеводов, ферментативную активность и устойчивость к определённым реагентам. Определение грамотрицательных бактерий проводилось на карте GN (Gram-Negative identification card), предназначенной для идентификации большинства клинически важных ферментирующих и неферментирующих грамотрицательных палочек и состоящей из 47 биохимических тестов, грамположительных бактерий – на карте GP (Gram-Positive), предназначенной для идентификации стафилококков, стрептококков, энтерококков, включающей 43 биохимических теста.
Чувствительность к антибиотикам выделенных изолятов определяли на картах к автоматизированной системе VITEK 2 Compact – Antimicrobial Susceptibility Test (AST) методом микроразведений в бульоне пограничных концентраций антибактериальных препаратов. Интерпретацию полученных результатов проводили в соответствии с рекомендациями EuropeanCommitteeonAntimicrobialSusceptibilityTesting (EUCAST) и ClinicalandLaboratoryStandardsInstitute (CLSI) для каждого вида бактерий.
Для контроля точности и правильности определения чувствительности микроорганизмов к антибиотикам параллельно с изолятами бактерий тестировались референс-штаммы P. aeruginosa ATCC 27853, Escherichia coliATCC 25922.
Чувствительность бактерий к антибиотикам определяли методом диффузии в агар антибактериальных препаратов, содержащихся в определённом количестве (в мкг) в коммерческих дисках и в градиентной концентрации (в мкг/мл) на специальных полосках, так называемых Е-тестах, комбинирующих метод серийных разведений и принципы диффузии в плотную среду (Oxoid, Великобритания;BioMerieux, Франция). Результаты интерпретировали в соответствии с рекомендациями EuropeanCommitteeonAntimicrobialSusceptibilityTesting (EUCAST) и ClinicalandLaboratoryStandardsInstitute (CLSI) для каждого вида бактерий[4],[5].
Все микроорганизмы, в зависимости от полученных результатов, были разделены на три группы – чувствительные (sensitive - S), умеренно-устойчивые(intermediate - I), устойчивые (resistant - R).
Статистический анализ полученных сведений проводился с помощью статистических функций встроенной библиотеки функций (пакет анализа – AnalysisToolРак) программы для работы с электронными таблицами Excel(MicrosoftOffice, 2013, Microsoft).
В отделениях нейрохирургического центрапериоперационная антибиотикопрофилактика проводилась в соответствии с указаниями Федеральных клинических рекомендаций «Принципы организации периоперационной антибиотикопрофилактики в учреждениях здравоохранения» [26] и Российскими клиническими рекомендациями «Программой СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи»[22] и выполняется путём однократного введения, за 30 минут до предполагаемого вмешательства, препарата Цефазолин в дозе 2,0 г,далее – введение каждые 6 часов в течение первых суток послеоперационного периода.
Комплекс профилактических мероприятий включал также контроль за выполнением правил обработки рук медицинским персоналом, за своевременной обработкой и заменой сосудистых и интравентрикулярных катетеров, за качеством воздуха и дезинфекцией поверхностей в операционном и нейрореанимационном отделениях, за использованием изделий медицинского назначения однократного применения, за обеззараживанием наркозно-дыхательной аппаратуры.
Эмпирическая антибактериальная терапия при подозрении на наличие вторичного гнойного менингита проводилась комбинацией препаратов: цефалоспорины III поколения (обычно использовался цефтриаксон в суточной дозе 4г) с ванкомицином (в суточной дозе 2г) [27].
Результаты
Ежегодные выборки пациентов с учетом их возраста, пола, заболеваний, проведенных по поводу этих заболеваний оперативных хирургических вмешательств были сходными, данные представлены ниже (табл. 1, рис. 1, рис. 2).
Таблица 1. Число пациентовОРИТ нейрохирургического центра в 2013-2017, их половозрастная характеристика, число проведенных пациентам операций, средний койко-день в ОРИТ
Table 1. Number, Age and Sex of the patients, mean patient day of the neurosurgical ICU, number of surgical operations, performed in patientsbefore admission to neurosurgical ICU
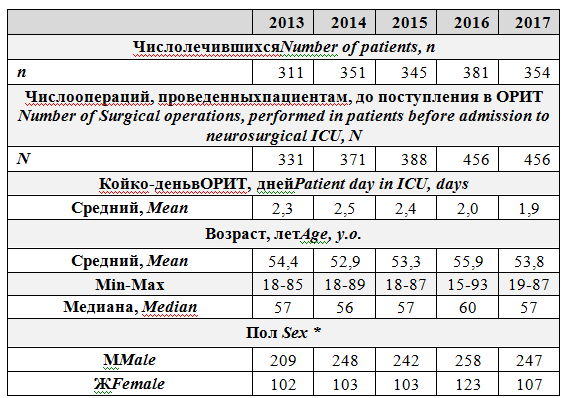
* - gender distribution is associated with the characteristics of the military medical institution* - распределение пациентов по полу связано с особенностями военно-медицинского учреждения
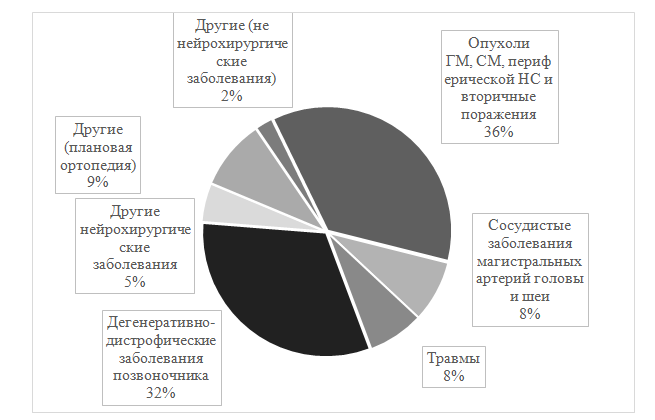
Рис.1. Структура патологии пациентов, проходящих лечение в ОРИТнейрохирургического центра в 2013-2017
Fig.1. NeurosurgicalICUPatients’ diseases in 2013-2017
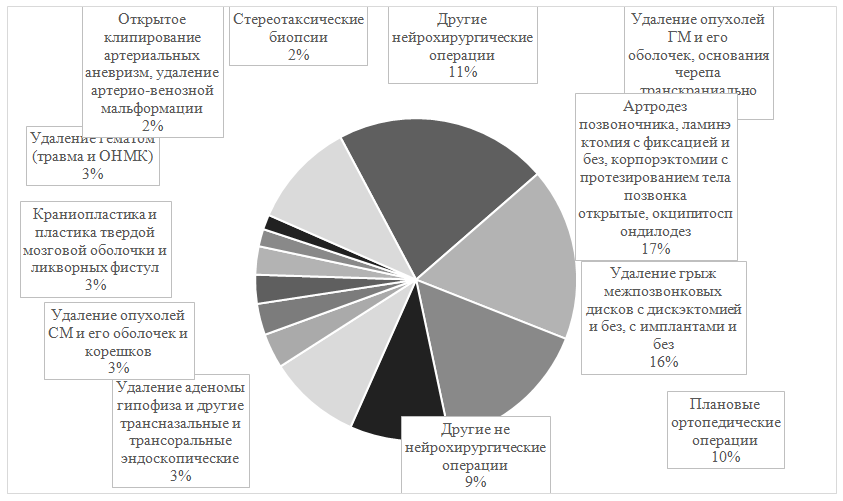

Fig.2. Surgical operations, performed in patients before admission to neurosurgical ICUРис.2. Структура операций, проведенных пациентам, находящимся в ОРИТ нейрохирургического центрав 2013-2017
Большая часть пациентов поступала в ОРИТ после проведенных плановых нейрохирургических операций на головном мозге (51%) и позвоночнике (32%) (рис. 1, рис. 2). Только 11% пациентов находилось в нейрохирургической ОРИТ не по профилю (после плановых ортопедических операций - 9% и пациенты с быстро развивающимися осложнениями или обострениями хронических заболеваний из находящихся рядом с ОРИТ отделений – 2%).
Таблица 2.Характеристика биоматериала из клинически значимых областей интересов у пациентов ОРИТ нейрохирургического центра и результаты микробиологических исследований в 2013-2017
Table 2.Samples from clinically significant areas of interest in neurosurgical ICU patients and the results of microbiological studies in 2013-2017
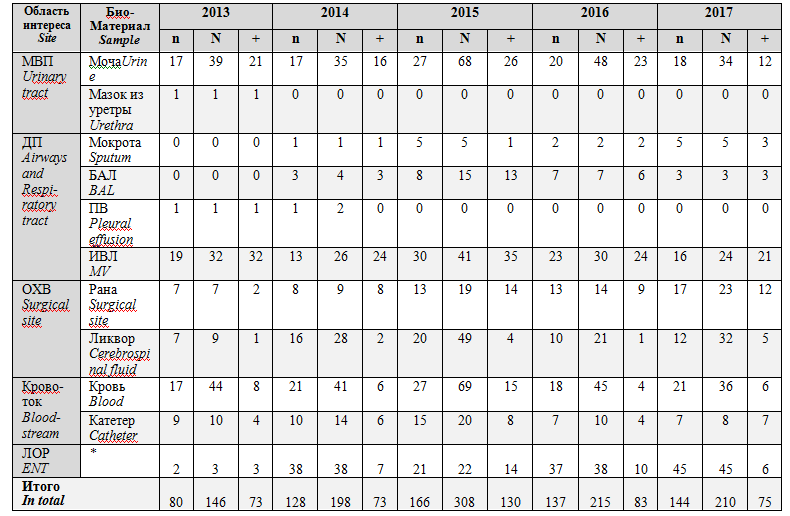

Вструктуреположительных результатовмикробиологическихисследованийв 2013-2017 было зарегистрировано около 60 микроорганизмов, наиболее часто выявляемые из них представлены ниже (рис. 3).
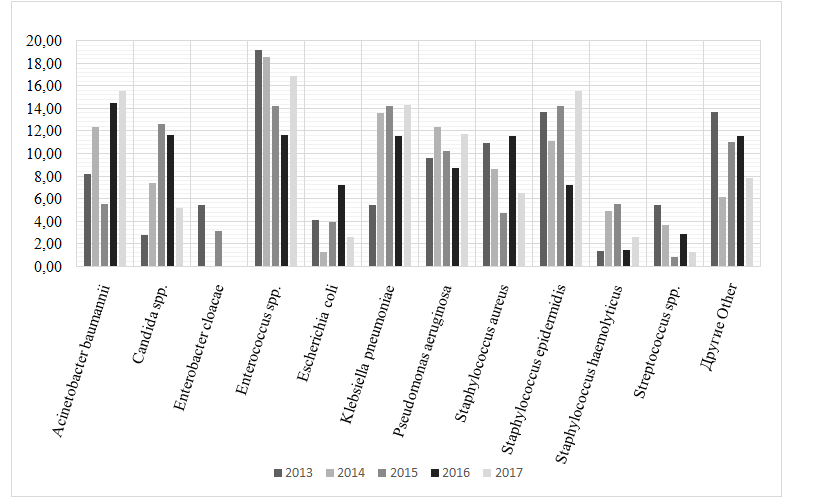
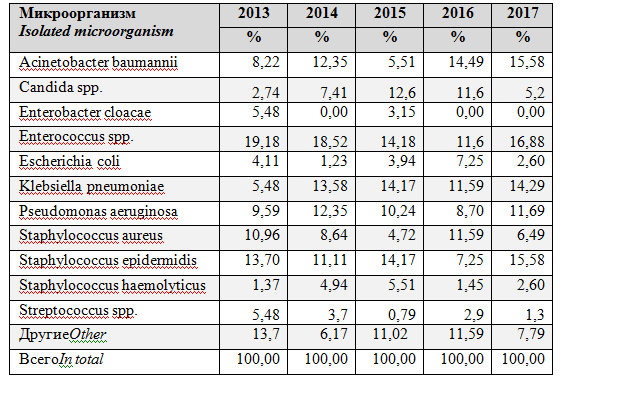
Рис. 3.Динамика выявления изолятов микробнойи грибковой флорыу больных в ОРИТ нейрохирургического центра в 2013-2017
Fig.3. The isolated patogens in patientsofneurosurgicalICU in 2013-2017
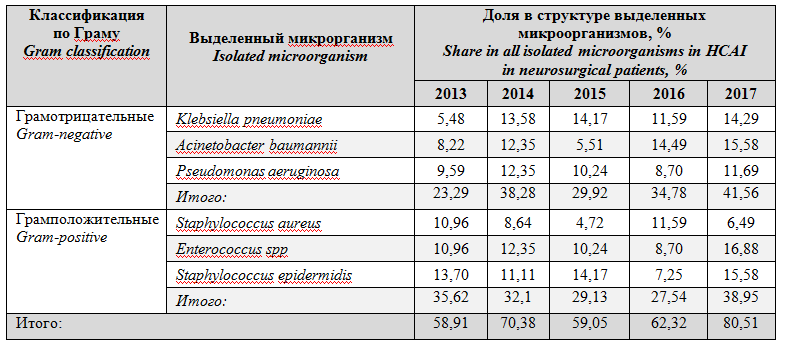
В 2013-2017 по результатам микробиологических исследований отмечено динамическое увеличение доли A. baumannii с 8,22% в 2013 до 15,58% в 2017 и K. pneumoniae с 5,48% в 2013 до 14,29% в 2017 году, стабильная значимая выявляемость P. aeruginosaс тенденцией к увеличению (с 9,59% в 2013 до 11,69% в 2017).
Стабильно выявлялсяEnterococcus spp.на значимо высоком уровне и былпредставлен, преимущественно, E. faecalis и E. faecium. На протяжении всего анализируемого периода времени отмечено доминированиеE. faecalis (10,96% - в 2013, 12,35% - в 2014, 10,24% - в 2015, 8,70%- в 2016, 6,49%- в 2017)и отсутствие тенденции к увеличению E. faecium(8,22% - в 2013, 6,17% - в 2014, 3,94% - в 2015 и 2,90% - в 2016) в структуре выделенных энтерококков.
Обращает на себя внимание статистически достоверное динамическое увеличение доли грамотрицательной микрофлоры в структуре выделенных микроорганизмов в период 2013-2017, при этом выделение из клинически значимых локусов грибов (в большинстве случаев -дрожжеподобных грибов рода Candida)отмечалось на относительно стабильных уровнях, динамические изменения были мало достоверны статистически (рис. 4).
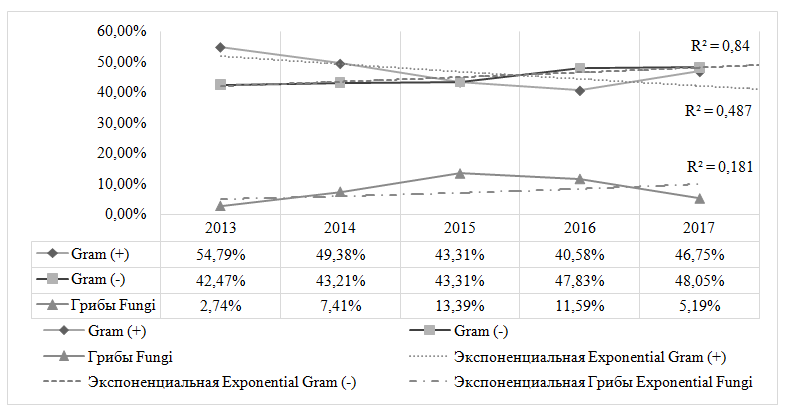
Рис.4.Структураклассифицированных по Граму микроорганизмови грибов, выделенных у пациентов ОРИТ нейрохирургического центра в 2013-2017
Fig.4Isolated Gram classifed microorganusms and Fungi rates in patient of neurosurgical ICUin 2015-2017
При анализе микробного пейзажа отмечено, что в ОРИТ нейрохирургического центра наибольшую значимость в структуре возбудителей ИСМП изграм-отрицательных патогеновимеют K. pneumoniae, A. baumannii, P. aeruginosa, аизграм-положительных - S. aureus, E.faecalisиS.Epidermidis, причем общая доля этих шести микроорганизмов прогрессивно увеличивается с 58,91% в 2013 до 80,51% в 2017 (табл. 3).
Таблица3. Наиболее часто изолируемая микрофлора у пациентов в ОРИТ нейрохирургического центра в 2013-2017
Table3.Most frequently isolated microorganisms in patients of neurosurgical ICU in 2013-2017
Проведённый анализ антимикробной активности антибиотиков, наиболее часто используемых в нейрохирургическом центре в период с 2013 по 2017, отметил снижение антимикробной активности большинства используемых антибактериальных препаратов. Наибольшее снижение антимикробной активности отмечено у антибиотиков из группы аминогликозидов – гентамицина и амикацина, бета-лактамного антибиотика – амоксициллин/клавулановая кислота и препарата из группы фторхинолонов – левофлоксацина. Так, если в 2013, в структуре выделенных микроорганизмов, к гентамицину, амикацину, амоксициллину/клавулановой кислоте и левофлоксацину чувствительность проявляли 48,0%, 70,97%, 22,2% и 42,37% изолятов соответственно, то в 2017 к гентамицину и амикацину проявляли чувствительность – 26,67% и 41,67% выделенных изолятов, к левофлоксацину иамоксициллину/клавулановой кислоте чувствительность не выявлялась. В анализируемый период исключение составляли препараты из группы гликопептидов – ванкомицин и из группы оксазолидинонов – линезолид, чувствительность к которым сохранялась на уровнях близких к 100% (рис.5).
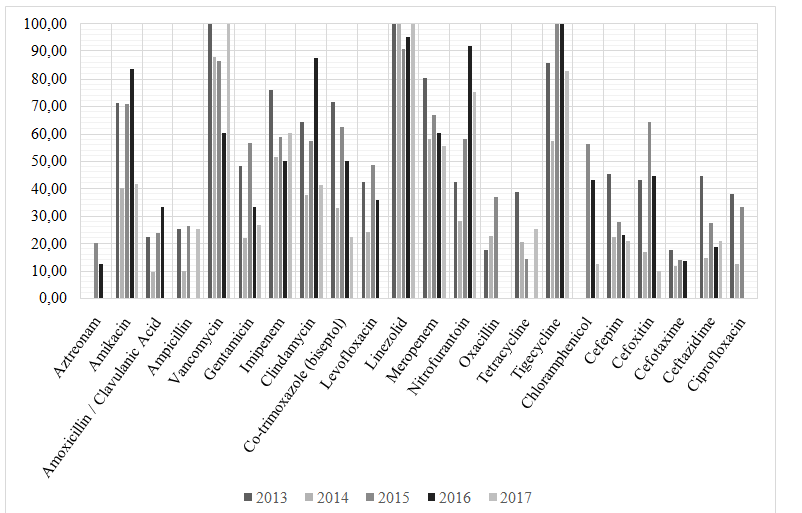
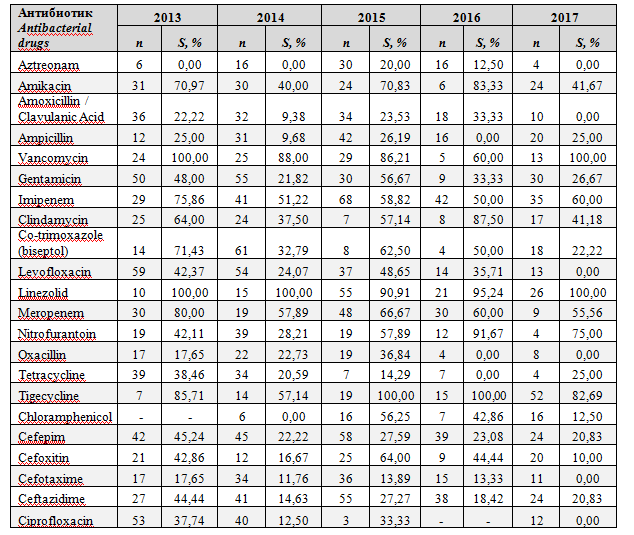
Рис.5.Динамика антимикробной активности наиболее часто применяемых при ИСМП антибактериальных препаратов в 2013-2017

Fig.5.Antimicrobial activity of the most used in HCAIantibacterial drugs in 2013-2017
Обсуждение
Микробный пейзаж при ИСМП и профили антибиотикорезистентности ведущих возбудителей в ОРИТ и другихкоечных отделениях зависит от региональных и локальных особенностей медицинской организации - структуры ИСМП (соотношений ИОХВ, ВП, ИМП, КАИК), во многом зависящих от структуры заболеваний и оперативных хирургических вмешательств, а также от особенностей применения антибактериальной терапии и антибиотикопрофилактики,и изменяется со временем.
По данным литературы известно, что в 1970-1980-х среди возбудителей ИСМП значимую долю занимали грамотрицательные бактерии, среди которых преобладали кишечная палочка, клебсиеллы, энтеробактеры, псевдомонады. В конце 20 века причиной более 65% ВБИ были грамположительные бактерии - стафилококки, стрептококки, энтерококки. В последние 10-20 лет отмечается тенденция к возврату грамотрицательных бактерий на лидирующие позиции в структуре возбудителей ИСМП. Происходит это в основном за счет полирезистентных грамотрицательных бактерий семейства Enterobacteriaceae и грамотрицательных неферментирующих бактерий -Е. coli, Klebsiella spp., Enterobacter spp., Pseudomonasspp., Acinetobacterspp.и др.
Выявленный в нашем исследовании микробный пейзаж и его динамическое изменение в целом характерныдля хирургических стационаров и ОРИТ хирургического профиля (особенно для «чистых» операций внейрохирургии и сосудистой хирургии) в России и в развитых зарубежных странахв настоящее время.
Так, проведенное в 1997-1998 проспективное исследование в ОРИТ нейрохирургического профиля в Университетской больнице Фрайбурга (Германия) идентифицировало следующие патогены при ИСМП:E.coli–в 14.6%, Enterococci–в 10.2%, S. aureus - в 9.6%, Coagulase-negativestaphylococci–в 6.4%, Klebsiellaspp.–в 6.4%, Enterobacterspp.–в 5.1%, Pseudomonasspp.–в 5.1%[28].
Двухлетнее проспективное когортное исследование нозокомиальных инфекций в 15-коечном ОРИТ смешанного (хирургического и терапевтического) профиля в госпитале Кувейта в 2004-2005 показало, что причиной ИСМП была грам-отрицательная флора - в 68% случаев, грам-положительная флора - в 27%, грибы – в 5% случаев, при этом наиболее часто выявлялась P. aeruginosa (17%), A. baumannii (13%), Klebsiella spp. (11%) и E. coli (8%) [29].
По данным 6-летнего наблюдательного исследования ИСМП в неврологическом ОРИТ , проведенного с 2001-2010 в Монреале (Канада), наиболее часто выделялись изоляты Escherichia coli (в 22%), S. aureus (в 14%), Klebsiella spp. (в 9%), Pseudomonus spp (в 6,6%), которые были ответственны за развитие ИМП и пневмонии; Enterococcus (в 6,6%), выявляемые при ИМП; S. epidermidis (в 5,3%); Streptococcus pneumoniae (в 4,5%); другие Enterobacteriaceae (в 11,5%). 97% изолятовS. aureus были чувствительны к оксациллину, 94% изолятов Enterobacteriaceae проявляли чувствительность к цефалоспоринам 3-го поколения, резистентность к ванкомицину и карбапенему отсутствовала. Изоляты Pseudomonasspp проявляли чувствительность к имипенему в 88%, ципрофлоксацину – в 93%, и в 100% - к гентамицину и пиперациллину/тазобактаму [18].
В 2002-2004 в Риме (Италия) в проведенном в ОРИТ нейрохирургического профиля проспективном исследовании были получены следующие результаты микробного пейзажа и антибиотикорезистентности: среди возбудителей ИСМП доминировала грам-отрицательная бактериальная флора - в 54,5%, грам-позитивная отмечалась в 33,3%, а грибы выделялись в 12,2% случаев. Наиболее частыми изолированными микроорганизмами былиP. aeruginosa (24.4%), Staphylococcus spp.(22.2%), K. pneumoniae (11,1%), коагулазо-негативные стафилококки (8,3%), Candida spp. (11,66%). Полимикробная флора встречалась в 28.8%.Самыми частыми возбудителями были: при КАИК - E. faecalis и S. aureus, при ВП - P. aeruginosa и S. aureus, при ИМП - Candida spp. Почти все – 93,3% изолятов коагулазо-негативных стафилококков относились к MRS, и большая часть – 68,0% изолятов S. aureus проявляли метициллин-резистентность.Более трети - 36.4% изолятов P. aeruginosa проявляли резистентность к карбапенемам. 75% изолятов K. pneumoniae ESBL проявляли полирезистентность к антибиотикам. Была также отмечена полирезистентность 50% изолятов Corynebacterium spp.[30].
Результаты ретроспективного исследования случаев ВБИ в нейрохирургических отделениях больниц Кишинева (Молдавия) в период до 2008 (периодрегистрации случаев в описании исследования не указан) несколько отличаются от результатов другихисследований, что может быть связано с особенностями структуры ВБИ (высокая распространенность ИОХВ, низкая распространенность ИМП) и антибиотикопрофилактики (в описании исследования наличие и особенности антибиотикопрофилактики не указаны), а также региональными социально-экономическими особенностями. ВБИ включали:инфицированные хирургические раны – 31,0%, ВП – 43,9%, менингоэнцефалиты – 18,9%, сепсис – 3,4%, ИМП – 1,7% (низкая распространенность ИМП может быть связанас особенностями регистрации). В общем микробном пейзаже возбудителей ВБИ преобладали грамположительные микроорганизмы (49,3% из общего количества выделенных штаммов), включая S. aureus – 11,61%, S. epidermidis –14,78%, S. saprophyticus – 8,80%, S. faecium – 4,22%, S. Faecalis– 4,22%, Corynebacterium – 4,57%. Грамотрицательные микроорганизмы составляли 38,38% из общего числа выделенных штаммов, в том числе,Acinetobacter – 11,26%, P. aeruginosa – 7,04%, K. Pneumoniae– 5,63%, E. coli – 4,57%, Proteus spp.– 4,92%. В содержимом инфицированных ран преобладают грамположительные микроорганизмы - 53,57% (в том числе, Staphylococcus spp. - 36,9%, Streptococcus spp. - 12,6%), из грамотрицательных микроорганизмов чаще были выделены P. aeruginosa - 7,8% иK. pneumoniae- 7,8%. Из ликвора и крови, при генерализованных инфекциях, чаще были выделены штаммы Acinetobacter – 27,6 и 23,3%,S. epidermidis – 25,9 и 13,4%, а также S. saprophyticus – 6,9 и 20,0%, соответственно. Из проб мочи чаще были выделены штаммы грамотрицательныхмикроорганизмов, как E. coli – 17,9%, P. aeruginosa, K. pneumoniae и Candida – по 10,7%. Антибиотикорезистентность проявили 49,9% изолятов, наибольшая антибиотикорезистентность была выявлена у грамотрицательных микроорганизмов - в 62,5% исследований [9].
По данным проведенного в 2013 первого в России проспективного многоцентрового обсервационного исследования ЭРГИНИ в этиологии ИСМПв ОРИТ, терапевтических, хирургических, неврологических, урологических отделениях превалировала грамотрицательная флора (58,8%), реже встречались грамположительная флора (32,8%) и грибы (8,4%). Наиболее частыми возбудителями среди грамотрицательных бактерий были Klebsiella spp. – 19,6%, E. coli – 12,2%, Acinetobacter spp. –10,9%, P. aeruginosa – 7,1%, Proteusmirabilis – 4,5%, Enterobacterspp. – 1,9%. Наиболее частыми возбудителями среди грамположительных бактерий были S. aureus – 11,3%, E. faecalis- 7,4%, Staphylococcus CN– 5,1%, E. faecium– 3,2%, Streptococcus pyogenes – 1,3%. Среди возбудителей преобладали полирезистентные микроорганизмы. Резистентность к цефалоспоринам изолятовE. coli наблюдалась в 60,5%, изолятов Klebsiella spp. - в 95,1%. Только 26,5% изолятов Acinetobacter spp. и 59,1% изолятов P. aeruginosaбыли чувствительны к карбапенемам. Частота выявляемости MRSA составила 48,6%; к ампициллину были резистентны 17,4% изолятов E. faecalis[31].
Широкое применение антибиотикопрофилактики значительно снижает количество послеоперационных осложнений инфекций области хирургического вмешательства, но при этом возрастает антибиотикорезистентность возбудителей и появляются штаммы микроорганизмовс множественной антибиотикорезистентностью, отмечается увеличение количества и доли ИМП и ВП в структуре ИСМП[32].
Учитывая высокую клиническую значимость некоторых патогенов, в отчете Американскогообществаинфекционныхболезней (InfectiousDiseasesSocietyofAmerica - IDSA) в 2009 была выделена группа патогенов, названная ESKAPE, включающаяE. faecium, S. aureus, K. pneumoniae, A. baumannii, P. aeruginosa и Enterobactersp.,ответственных за большую часть внутрибольничных нфекцийв США и демонстрирующих наибольшую антибиотикорезистентность [33–36].
В связи с высокой актуальностью проблемы возрастающей антибиотикорезистентности некоторых патогенов по результатам статистических отчетов стран-участников ВОЗ составила Перечень наиболее важных для антибиотикорезистентности патогенов для последующих исследований и разработки новых антибактериальных средств. Из вышеуказанных ESKAPE–патогенов в первую (критическую) категорию приоритетности были включены устойчивые к карбапенемам: A. baumannii, P. aeruginosa и Enterobacteriaceae (включая K. pneumonia, Enterobacter sp.,вырабатывающие БЛРС и резистентные также к цефалоспоринам 3-го поколения). Во вторую высокую категорию приоритетности вошли E. faecium, устойчивый к ванкомицину и S. aureus, устойчивый к метициллину, умеренно чувствительный или устойчивый к ванкомицину[37].
Однако, только разработка новых антимикробных препаратов для преодоления известных механизмов резистентности не может полностью решить проблему устойчивости современных возбудителей ИСМП.
Выводы
По результатам проведенного нами исследования вОРИТ нейрохирургических больныхбыло выявлено, что наибольшее клинико-эпидемиологическое значение в структуре выявляемых агентов занимает грамотрицательная микрофлора, доля ее увеличилась за пятилетний срок наблюдения.
В ОРИТ нейрохирургических центранаибольшую значимость в структуре возбудителей ИСМП имеют Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Staphylococcus aureus, Enterococcus faecalis и Staphylococcus epidermidis. Выделенные изоляты, в особенности Acinetobacter baumannii, проявляют высокий уровень резистентности к антибактериальным препаратам, что требует своевременного назначения и коррекции рациональной антибактериальной терапии.
В клинической практике нейрохирургического центра, в случае возникновения ИСМП, используются антибактериальные препараты из групп фторхинолонов, цефалоспоринов III-IV поколения, карбапенемы, аминогликозиды и препараты из группы гликопептидов (ванкомицин). Полученные данные антимикробной активности антибиотиков демонстрируют значительное снижение чувствительности ведущих патогенов к наиболее часто применяемым антибактериальным препаратам. Приэтом, если для лечения инфекций, обусловленных грамположительной микрофлорой, сохраняются резервы для подбора антибактериальной терапии (антибактериальная активность ванкомицина и линезолида сохраняется на высоких цифрах), то для лечения инфекций, вызванных грамотрицательными микроорганизмами, возможности существенно ограничены.
Существующие рекомендации по проведению периоперационной антибиотикопрофилактики цефазолином сохраняют свою актуальность. При проведении эмпирической антибактериальной терапии оправдано использование комбинации ванкомицина с цефалоспоринами III поколения до получения результатов микробиологического исследования. Увеличение доли резистентных микроорганизмов усложняет антибиотикотерапию, требует использования нескольких антибиотиков, повышает значимость профилактических мероприятий.
Заключение
Увеличение частоты выделения микроорганизмов с множественной устойчивостью к антибактериальным препаратам ограничивает возможности для проведения адекватной антибактериальной терапии ИСМП и выводит на первый план профилактические мероприятия.
Особое внимание нужно уделять сокращению длительности пребывания пациентов в коечных отделениях перед выполнением оперативного вмешательства и после него, сокращению длительности пребывания в ОРИТ, проведению регулярного микробиологического мониторинга возбудителей ИСМП и их антибиотикорезистентности, а также рациональному использованию антибактериальных препаратов.
Использование антибактериальных препаратов может считаться рациональным если соблюдаются следующие условия: антибактериальная терапия начинается неотложно после диагностики инфекции до получения результатов бактериологического исследования, но после забора материала для микробиологического исследования; выбор стартового эмпирического режима терапии должен быть регламентирован с учетом вероятного спектра возбудителей (в зависимости от локализации очага инфекции) и их возможной устойчивости (с учетом данных локального мониторинга антибиотикорезистентности в медицинской организации); при тяжелых инфекциях применение эмпирической терапии с максимально полным охватом всех потенциальных возбудителей инфекции данной локализации и учетом возможной антибиотикорезистентности; первоначальную оценку эффективности терапии проводят в течение 48–72 часов после начала лечения, ориентируясь на динамику симптомов; антибиотикопрофилактика проводится не дольше, чем 24 часа после операции при отсутствии признаков инфекции [15].
Постоянное выполнение всего комплекса профилактических мер, направленных на профилактику ВБИ, регулярный контроль за их соблюдением приводят к снижению частоты развития опасных осложнений госпитализации - ИСМП.
[1]Санитарно-эпидемиологические правила и нормативы СанПиН 2.1.3.2630-10 "Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность" (утв. постановлением Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58). С изменениями и дополнениями от: 4 марта, 10 июня 2016 г.
[2]Методы контроля. Биологические и микробиологические факторы. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории. Методические указания. МУ 4.2.2039-05. М., 2006. https://legalacts.ru/doc/mu-422039-05-42-metody-kontrolja-biologicheskie-i/
[3]Vitek2 – Compact. Software Version: V2S R-07.01. 19.02.14. Userguide: BioMerieux; 2014.
[4]European Committee on Antimicrobial Susceptibility Testing (EUCAST). Breakpoint tables for interpretation of MICs and zone diameters. Version 4.0 2014. http://www.eucast.org.
[5]Performance Standards for Antimicrobial Susceptibility Testing; Twenty First Informational Supplement, CLSI document M100-S24. Wayne, PA: Clinical and Laboratory Standards Institute; 2014. https://clsi.org/standards/products/microbiology/
1. Donaldson L. World Alliance for Patient Safety. Forward Programme. WHO; 2004.
2. Pokrovsky VI, Akimkin VG, Briko NI, Brusina YB, Blagonravova AS, Zuyeva LP, Kovalishena OV, Stasenko VL, Tutel’yan AV, Fel’dblyum IV, Shkarin VV. Terminologicheskiye aspekty infektsiy, svyazannykh s okazaniyem meditsinskoy pomoshchi [Terminological Aspects of Healthcare-Associated Infections]. Zhurnal mikrobiologii, epidemiologii i immunobiologii [J of Microbiology, Epidemiology and Immunobiology]. 2011;(5):122-125. (In Russ.).
3. WHO/HSE/EPR/2009.1.Core components for infection prevention and control programmes. Report of the Second Meeting Informal Network on Infection Prevention and Control in Health Care. Geneva, Switzerland; 26-27 June 2008.
4. McKibben L, Horan T, Tokars JI, Fowler G, Cardo DM, Pearson ML, Brennan PJ, Heathcare Infection Control Practices Advisory Committee. Guidance on public reporting of healthcare-associated infections: recommendations of the Healthcare Infection Control Practices Advisory Committee. Am J Infect Control. 2005;33(4):217-226. doihttps://doi.org/10.1016/j.ajic.2005.04.001.
5. Brusina EB, Zuyeva LP, Kovalishena O V., Stasenko VL, Feldblium I V., Briko NI, Akimkin VG. Healthcare-Associated Infections: Modern Doctrine of Prophylaxis. Part II. Basic Concept. Epidemiol Vaccine Prev. 2019;17(6):4-10. (In Russ.). doihttps://doi.org/10.31631/2073-3046-2018-17-4-10.
6. Orlova OA. Comparative Characteristics of the Incidence of Healthcare-Associated Infections in the Chelyabinsk region and in the Russian Federation in Total. Epidemiol Vaccine Prev. 2015;14(5):56-61. (In Russ.). doihttps://doi.org/10.31631/2073-3046-2015-14-5-56-61.
7. European Centre for Disease Prevention and Control. Surveillance of Surgical Site Infections and Prevention Indicators in European Hospitals - HAI-Net SSI Protocol, Version 2.2. Stockholm: ECDC; 2017. doihttps://doi.org/10.2900/260119.
8. O sostoyanii sanitarno-epidemiologicheskogo blagopoluchiya naseleniya v Rossiiskoi Federatsii v 2018 godu. Gosudarstvennyy doklad [About a condition of sanitary and epidemiologic wellbeing of the population in the Russian Federation in 2018: State report]. Moscow: Rospotrebnadzor; 2019. (In Russ.).
9. Prisakar VI, Zapukhlykh GV, Leu EL. Epidemiologicheskiye osobennosti vnutribol’nichnykh neyrokhirurgicheskikh infektsiy [Epidemiological features of hospital acquired infections in neurosurgical patients]. Meditsinskii al’manakh. 2009;7(2):63-68. (In Russ).
10. Abdul-Jabbar A, Takemoto S, Weber MH, Hu SS, Mummaneni P V., Deviren V, Ames CP, Chou D, Weinstein PR, Burch S, Berven SH. Surgical Site Infection in Spinal Surgery. Spine (Phila Pa 1976). 2012;37(15):1340-1345. doihttps://doi.org/10.1097/BRS.0b013e318246a53a.
11. Scheithauer S, Burgel U, Ryang Y-M, Haase G, Schiefer J, Koch S, Hafner H, Lemmen S. Prospective surveillance of drain associated meningitis/ventriculitis in a neurosurgery and neurological intensive care unit. J Neurol Neurosurg Psychiatry. 2009;80(12):1381-1385. doihttps://doi.org/10.1136/jnnp.2008.165357.
12. Yamada K, Abe H, Higashikawa A, Tonosu J, Kuniya T, Nakajima K, Fujii H, Niwa K, Shinozaki T, Watanabe K, Sakae T, Okazaki H. Evidence-based Care Bundles for Preventing Surgical Site Infections in Spinal Instrumentation Surgery. Spine (Phila Pa 1976). 2018;43(24):1765-1773. doihttps://doi.org/10.1097/BRS.0000000000002709.
13. Tay L, Ong PL, Lang L. Nosocomial infections in a neurosurgery department. Ann Acad Med Singapore. 1987;16(4):565-570. http://www.ncbi.nlm.nih.gov/pubmed/3445999.
14. Rosenthal VD, Maki DG, Salomao R, Moreno CA, Mehta Y, Higuera F, Cuellar LE, Arikan OA, Abouqal R, Leblebicioglu H, International Nosocomial Infection Control Consortium. Device-associated nosocomial infections in 55 intensive care units of 8 developing countries. Ann Intern Med. 2006;145(8):582-591. doihttps://doi.org/10.7326/0003-4819-145-8-200610170-00007.
15. Commichau C, Scarmeas N, Mayer SA. Risk factors for fever in the neurologic intensive care unit. Neurology. 2003;60(5):837-841. doihttps://doi.org/10.1212/01.wnl.0000047344.28843.eb.
16. Kilpatrick MM, Lowry DW, Firlik AD, Yonas H, Marion DW. Hyperthermia in the neurosurgical intensive care unit. Neurosurgery. 2000;47(4):850-855; discussion 855-6. doihttps://doi.org/10.1097/00006123-200010000-00011.
17. Laborde G, Grosskopf U, Schmieder K, Harders A, Klimek L, Hardenack M, Gilsbach JM. [Nosocomial infections in a neurosurgical intensive care unit]. Anaesthesist. 1993;42(10):724-731. http://www.ncbi.nlm.nih.gov/pubmed/8250207.
18. Abulhasan YB, Rachel SP, Châtillon-Angle M-O, Alabdulraheem N, Schiller I, Dendukuri N, Angle MR, Frenette C. Healthcare-associated infections in the neurological intensive care unit: Results of a 6-year surveillance study at a major tertiary care center. Am J Infect Control. 2018;46(6):656-662. doihttps://doi.org/10.1016/j.ajic.2017.12.001.
19. O’Shea M, Crandon I, Harding H, Donaldson G, Bruce C, Ehikhametalor K. Infections in neurosurgical patients admitted to the intensive care unit at the University Hospital of the West Indies. West Indian Med J. 2004;53(3):159-163. http://www.ncbi.nlm.nih.gov/pubmed/15352744.
20. Rubeli SL, D’Alonzo D, Mueller B, Bartlomé N, Fankhauser H, Bucheli E, Conen A, Fandino J, Fux CA. Implementation of an infection prevention bundle is associated with reduced surgical site infections in cranial neurosurgery. Neurosurg Focus. 2019;47(2):E3. doihttps://doi.org/10.3171/2019.5.FOCUS19272.
21. Jamjoom AAB, Joannides AJ, Poon MT-C, Chari A, Zaben M, Abdulla MAH, Roach J, Glancz LJ, Solth A, Duddy J, Brennan PM, Bayston R, Bulters DO, Mallucci CL, Jenkinson MD, Gray WP, Kandasamy J, Hutchinson PJ, Kolias AG, Ahmed AI. Prospective, multicentre study of external ventricular drainage-related infections in the UK and Ireland. J Neurol Neurosurg Psychiatry. 2018;89(2):120-126. doihttps://doi.org/10.1136/jnnp-2017-316415.
22. Yakovlev SV, Briko NI, Sidorenko SV. , et al. Programma SKAT (Strategiya Kontrolya Antimikrobnoi Terapii) pri okazanii statsionarnoi meditsinskoi pomoshchi: Rossiiskie klinicheskie rekomendatsii [SCAT (Antimicrobial Therapy Control Strategy) for inpatient care: Russian clinical guidelines]. In: Moscow. Izdatel’stvo «Pero»; 2018:156. (In Russ). doihttps://doi.org/10.17513/np.318.
23. Raffaldi I, Scolfaro C, Pinon M, Garazzino S, Dalmasso P, Calitri C, Peretta P, Ragazzi P, Gaglini PP, Pretti PF, Vitale P, Conio A, Tovo P-A. Surveillance Study of Healthcare-Associated Infections in a Pediatric Neurosurgery Unit in Italy. Pediatr Neurosurg. 2011;47(4):261-265. doihttps://doi.org/10.1159/000335401.
24. Chen Y, Zhang L, Qin T, Wang Z, Li Y, Gu B. Evaluation of neurosurgical implant infection rates and associated pathogens: evidence from 1118 postoperative infections. Neurosurg Focus. 2019;47(2):E6. doihttps://doi.org/10.3171/2019.5.FOCUS18582.
25. Stephens FL, Mossop CM, Bell RS, Tigno T, Rosner MK, Kumar A, Moores LE, Armonda RA. Cranioplasty complications following wartime decompressive craniectomy. Neurosurg Focus. 2010;28(5):E3. doihttps://doi.org/10.3171/2010.2.FOCUS1026.
26. Aslanov BI, Zuyeva LP, Kolosovskaya YN, Lyubimova AV, Khoroshilov VY, Dolgiy AA, Dar’ina MG, Tekhova IG. Printsipy organizatsii perioperatsionnoy antibiotikoprofilaktiki v uchrezhdeniyakh zdravookhraneniya. Federal’nyye klinicheskiye rekomendatsii [The principles of perioperative antibiotic prophylaxis in healthcare facilities. Federal clinical guidelines]. In: Moscow; 2014:42. (In Russ).
27. Strachunskii LS, Belousov YB, Kozlov SN. , ed. Prakticheskoye rukovodstvo po antiinfektsionnoy khimioterapii [Practical guide to anti-infective chemotherapy]. Smolensk: NIIAKh SGMA; 2007. (In Russ.).
28. Dettenkofer M, Ebner W, Hans F-J, Forster D, Babikir R, Zentner J, Pelz K, Daschner FD. Nosocomial Infections in a Neurosurgery Intensive Care Unit. Acta Neurochir (Wien). 1999;141(12):1303-1308. doihttps://doi.org/10.1007/s007010050434.
29. Aly NYA, Al-Mousa HH, Al Asar ESM. Nosocomial infections in a medical-surgical intensive care unit. Med Princ Pract. 2008;17(5):373-377. doihttps://doi.org/10.1159/000141500.
30. Orsi GB, Scorzolini L, Franchi C, Mondillo V, Rosa G, Venditti M. Hospital-acquired infection surveillance in a neurosurgical intensive care unit. J Hosp Infect. 2006;64(1):23-29. doihttps://doi.org/10.1016/j.jhin.2006.02.022.
31. Yakovlev SV, Suvorova MP, Beloborodov VB, Basin EE, Eliseev EV, Kovelenov SV, Portyagina US, Rog AA, Rudnov VA, Barkanova ON. Rasprostranennost i klinicheskoe znachenie nozokomialnyh infeksiy v lechebnyh uchrezhdeniyah Rossii: issledovanie ERGINI [Multicentre Study of the Prevalence and Clinical Value of Hospital-Acquired Infections in Emergency Hospitals of Russia: ERGINI Study]. Antibiotiki i Khimioterapiya [Antibiotics and Chemotherapy. 2016;(5-6):32-42. (In Russ.).
32. Orlova OA, Akimkin VG, Chistova AV, Ephremova NP. Kliniko-epidemiologicheskaya kharakteristika infektsiy, svyazannykh s okazaniyem meditsinskoy pomoshchi, v khirurgicheskikh statsionarakh [Clinical and Epidemiological characteristics infections associated with medical care in Surgical Hospitals]. Epidemiol i Vaktsinoprofilaktika [Epidemiology Vaccination]. 2014;(3):36-44. (In Russ.).
33. Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, Rice LB, Scheld M, Spellberg B, Bartlett J. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clin Infect Dis. 2009;48(1):1-12. doihttps://doi.org/10.1086/595011.
34. Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE. J Infect Dis. 2008;197(8):1079-1081. doihttps://doi.org/10.1086/533452.
35. Spellberg B, Guidos R, Gilbert D, Bradley J, Boucher HW, Scheld WM, Bartlett JG, Edwards J, Infectious Diseases Society of America. The epidemic of antibiotic-resistant infections: a call to action for the medical community from the Infectious Diseases Society of America. Clin Infect Dis. 2008;46(2):155-164. doihttps://doi.org/10.1086/524891.
36. National Nosocomial Infections Surveillance System. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 2004;32(8):470-485. doihttps://doi.org/10.1016/S0196655304005425.
37. WHO. Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. 27 February 2017. https://www.who.int/medicines/publications/global-priority-list-antibiotic-resistant-bacteria/en/. Accessed June 20, 2019.