Россия
Россия
ВАК 14.01.2023 Урология
УДК 61 Медицина. Охрана здоровья
ГРНТИ 76.29 Клиническая медицина
BISAC MED062000 Oncology
BISAC MED085000 Surgery / General
BISAC MED088000 Urology
Введение. По данным Минздрава России в 2016 г. от рака предстательной железы умерло 12 532 человека. За последние годы увеличилась выявляемость рака предстательной железы и снизилась стадия первично-выявленного рака, что увеличило количество больных, которым можно выполнить радикальное лечение. В настоящее время основным хирургическим методом лечения рака предстательной железы является радикальная простатэктомия. По современным представлениям основным методом профилактики послеоперационной стриктуры пузырно-уретрального анастомоза является формирование герметичного анастомоза с четким сопоставлением слизистых оболочек без натяжения тканей. Цель:исследовать ранние и отдаленные результаты применения методики исключениявнутрипросветных швов в формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомии. Задача: провести сравнительное исследование влияния внутрипросветных и не внутрипросветных швов при формировании пузырно-уретрального анастомоза на формирование послеоперационных стриктур задней уретры. Пациенты и методы. За период с января 2016 г. по декабрь 2018 г. нами было выполнено 126 позадилонных радикальных простатэктомий. Пациенты разделены на две группы. В первую группу (87 пациентов) включены больные, которым интраоперационно пузырно-уретральный анастомоз выполнялся по классической методике с применением внутрипросветных швов. Во вторую групп включены больные (39 пациентов), которым анастомоз формировался без применения внутрипросветных швов с выколом иглы в подслизистом слое В нашей клинике формирование пузырно-уретрального анастомоза выполнялось нитью Vicril 3/0. Всем пациентам на анастомоз накладывалось 5 лигатур. Герметичность анастомоза проверялась наполнением мочевого пузыря до 100 мл. Наполнение баллона катетера производилось до 17 мл. Всем пациентам проводилось обследование через 3, 6 и 9 месяцев после операционного периода. В план обследования входила компьютерная томография органов грудной, брюшной полости и малого таза с пероральным и внутривенным контрастированием; трансуретральное ультразвуковое исследование (ТРУЗИ), ультразвуковое исследование (УЗИ) мочевого пузыря с определением остаточной мочи и урофлоуметрия. При скорости мочеиспускания ниже 15 мл/с выполнялась ретроградная уретрография. Результаты. Средний койко-день, в течение которого выполнялось дренирование уретральным катетером в первой группе составил 10,3+3 дня, во второй 9,9+3 дня. В первой группе больных сужение пузырно-уретрального анастомоза после позадилонной радикальной простатэктомии развилось у 22 (25,2%) больных. Во второй группе больных стеноз пузырно-уретрального анастомоза развился у 6 (15,3%) пациентов. Выводы. Исключение внутрипросветных швов в формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомии позволяет снизить риск развития послеоперационной стриктуры на 9,9%. Данная техника позволяет отказаться от выворачивания слизистой мочевого пузыря, что может сократить время операции и снизить травматизацию тканей шейки мочевого пузыря.
рак предстательной железы; аденокарцинома; радикальная простатэктомия; пузырно-уретральный анастомоз; послеоперационные осложнения;сужение патологическое; стриктура задней уретры
Введение
Заболеваемость раком предстательной железы является глобальной проблемой здоровья населения и занимает значимое место в структуре онкологической заболеваемости мужчин развитых стран. В последние десятилетие отмечается рост заболеваемости, так, за 2016г. по данным Минздрава России от рака предстательной железы умерло 12 532 человека [1]. В США за 6 мес. 2019г. зарегистрировано 174,650 новых случаев рака предстательной железы,что составило 9,9% от всех новых случаев злокачественных опухолей за данный период в США. Умерли за этот период в США от данного заболевания 31620 человек, что составило 5,2% смертей от всех злокачественных новообразований за этот период [2]. При этом, в связи с повышением выявляемости снизилась стадия первично-выявленного рака, что увеличило количество больных, которым можно выполнить радикальное лечение, а также снизилась смертность от рака предстательной железы. По данным Национального института рака США пятилетняя выживаемость с 2009 по 2015 гг. составила 98% [2]. В настоящее время наряду с улучшением качества диагностики рака предстательной железы повысилась частота выбора радикальной простатэктомии среди других альтернативных методов лечения [3, 4]. Одним из послеоперационных осложнений, снижающих качество жизни пациента, является формирование послеоперационных стриктур уретры, по поводу которых иногда требуются повторные оперативные вмешательства. По данным отечественных авторов рубцовый стеноз уретры встречается у 1,3 - 22% больных. По данным национального института рака США (NationalCancerInstitute) рубцовый стеноз уретры встречается у 17,5% пациентов, перенесших радикальную простатэктомию любым из доступов (позадилонная, промежностная, лапароскопическая, роботизированная простатэктомия) [2]. По данным отечественных авторов рубцовые изменения, осложняющие послеоперационный период нарушением мочеиспускания, формируются в течение первых трех месяцев и занимают третье место в ряду осложнений [5]. Одним из факторов формирования данного осложнения является неадекватное сопоставление слизистой оболочки уретры и мочевого пузыря, несостоятельность анастомоза. По современным представлениям основным методом профилактики стриктуры является формирование герметичного анастомоза с четким сопоставлением слизистыхоболочек без натяжения тканей [6]. В 2003г. был предложен непрерывный шов пузырно-уретрального анастомоза, описанный R.F. vanVelthoven [7]. Многие авторы указывают на формирование анастомоза выворачивающими швами (везикализация) [8]. В литературе одним из важных факторов профилактики формирования стриктуры указывается сокращение сроков дренирования мочевого пузыря уретральным катетером, что снижает риск инфицирования мочевыводящих путей [9]. Сроки катетеризации мочевого пузыря при оперативном хирургическом лечении в настоящее время пытаются сократить до 10-14 суток [10].
Цель:исследовать ранние и отдаленные результаты применения методики исключениявнутрипросветных швов в формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомии.
Задача: провести сравнительное исследование влияниявнутрипросветныхи не внутрипросветныхшвов при формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомиина формирование послеоперационных стриктур задней уретры.
Материалы и методы
Нами проанализированы результаты лечения 126 пациентов, которым в онкоурологиеском отделении ГВКГ им.Н.Н.Бурденко за период с 1 января 2016г. по 31 декабря 2018г. была выполнена позадилонная радикальная простатэктомия. Всем пациентам по общепринятым диагностическим, клиническим, лабораторным и инструментальным методикам был установленлокализованный рак предстательной железы. Пациенты, включенные в исследование, были обследованы по стандартной методике в объеме клинико-лабораторного обследования, ультразвукового исследования, компьютерной томографии. Все больные были разделены на две группы: в первую (контрольную) группу вошли пациенты (87 человек), которым интраоперационно пузырно-уретральный анастомоз выполнялся по классической методике с формированием шейки мочевого пузыря по типу «теннисной ракетки» и наложением внутрипросветных швов на анастомоз. Во вторую группу (основную) включены больные (39 пациентов) которым анастомоз формировался без применения внутрипросветных швов с выколом иглы в подслизистом слое (Рис. 1).
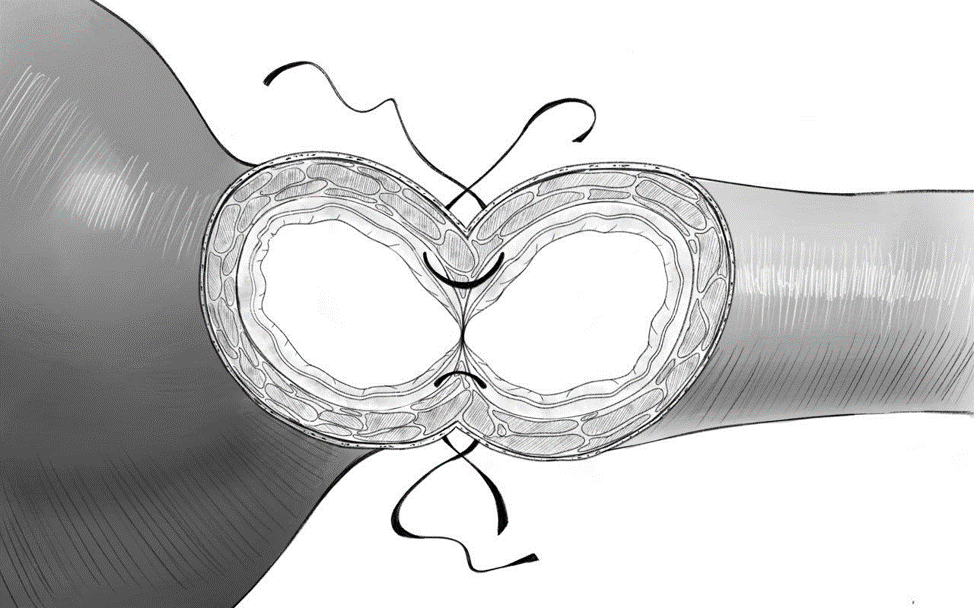
Рис.1. Схема наложения швов пузырно-уретрального анастомоза.
Fig. 1. The scheme of suturing vesico-urethral anastomosis.
У всех пациентов непосредственно на пузырно-уретральный анастомоз накладывалось 5 швов, формирование пузырно-уретрального анастомоза выполнялось нитью Vicril 3/0. Состоятельность анастомоза контролировалась наполнением мочевого пузыря посредством катетера до 100мл. 0,5% р-ром хлорида натрия. Наполнение баллона катетера производилось до 17мл. В послеоперационном периоде контроль состоятельности анастомоза оценивался исследованием уровня кретатинина в отделяемом по дренажам из паравезикальной клетчатки на 1-3 сутки.
Средний возраст больных в первой группе составил 67 ± 7,3 года (49-75 лет). Средний возраст больных во второй группе составил 66 ± 6,2 года (50-73 года).
В первой группе распределение больных по стадиям согласно гистологическом исследованию удаленного органа было следующим: рТ2аN0M0 – 17 пациентов, рТ2bN0M0 – 38 пациентов, рТ2сN0M0 – 11 больных, рТ3аN0M0 – 14 больных и рТ3bN0M0 – 7 пациентов. Во второй группе распределение больных по стадиям согласно гистологическом исследованию удаленного органа было следующим: рТ2аN0M0 - 7 пациентов, рТ2bN0M0 – 12 пациентов, рТ2сN0M0 – 6 больных, рТ3аN0M0 – 8 больных и рТ3bN0M0 – 6 пациентов.
Средний уровень простатического специфического антигена (ПСА) крови в первой группе составил 13,5 нг/мл, во второй - 12,2 нг/мл. Сумма Глисона как в первой, так и во второй группе был меньше или равен 7.
В послеоперационном периоде у 13 больных первой группы выявлен положительный хирургический край, по поводу чего проводилась дистанционная лучевая терапия. У 4 пациентов второй группы выявлен положительный хирургический край, что потребовало последующего проведения дистанционной лучевой терапии. В первой группе больных средний объем предстательной железы составил 66 ± 7см/3. Во второй группе пациентов средний объем железы составлял 69 ± 9 см/3. В контрольной группе больных нервосберегающаяпростатэктомия выполнена 19 (21,8%) пациентам во второй группе 8 (20,5%) больным. Данным больным операция была выполнена с сохранением пубо-простатических связок. В первой группе больных средний койко-день сохранения дренирования уретральным катетером составил 10,3 ± 3 дня, во второй 9,9 ± 3 дня что статистически является не значимым различием.
Результаты
Всем пациентам проводилось контрольное обследование через 3, 6 и 9 месяцев после операционного периода. В план обследования входила компьютерная томография органов грудной, брюшной полости и малого таза с пероральным и внутривенным контрастированием; ТРУЗИ, УЗИ мочевого пузыря с определением остаточной мочи и урофлоуметрия. При скорости мочеиспускания ниже 15 мл/с выполнялась ретроградная уретрография.
В первой группе больных у 7 отмечен рост ПСА, что потребовало проведения дистанционной лучевой терапии и гормонотерапии (антиандрогены + аналоги гонадотропин-рилизинг факторов) в течение 6 мес. Во второй группе больных таких пациентов было 7. Из них шести больным проведена дистанционная лучевая терапия и гормональная терапия. Один пациент из второй группы отказался от дистанционной лучевой терапии и получал только гормональную терапию в течение 6 мес. В нашем исследовании после удаления уретрального катетера ни у одного больного не развилось острой задержки мочеиспускания и при обследовании, по данным ультразвукового исследования, не было выявлено остаточной мочи более 50мл. Результаты полученные при исследовании мочеиспускания представлены в таблице 1.
Таблица 1.Виды задержки мочеиспускания и сроки развития ухудшения мочеиспускания у пациентов основной и контрольной групп
Table 1. The types of urinary retention and timing of development of the deterioration of urinationin patinets
|
|
|
I группа (n=87) I group |
IIгруппа (n=39) IIgroup |
|
1 |
Задержка мочеиспускания после удаления уретрального катетера Urinary retention after urethral catheter removal |
- |
- |
|
2 |
Острая задержка мочеиспускания в течение 3 мес. Acute urinary retention in 6 months |
7(8,0%) |
1(2,5%) |
|
3 |
Стриктура выявлена через 3 мес. Stricture was detected in 3 months |
8(9,2%) |
2(5,1%) |
|
4 |
Острая задержка мочеиспускания в течение 6 мес. Acute urinary retention in 6 months |
- |
- |
|
5 |
Стриктуравыявленачерез 6 мес. Stricture was detected in 6 months |
6(6,8%) |
1(2,5%) |
|
6 |
Острая задержка мочеиспускания в течение 9 мес. Acute urinary retention in 9 months |
- |
- |
|
7 |
Стриктуравыявленачерез 9 мес. Stricture was detected in 9 months |
1(1,15%) |
2(5,1%) |
Средняя скорость мочеиспускания при выявленном сужении уретры в первой группе больных составила 6 мл/с во второй 5мл/с. При этом средний объем остаточной мочи у пациентов, имеющих стриктуру пузырно-уретрального анастомоза в первой группе составил 87 ± 8мл/с, во второй 96 ± 9мл/с. Всем пациентам с выявленным сужением пузырно-уретрального анастомоза выполнена внутренняя оптическая уретротомия. Рецидив сужения развился у 5 больных первой группы и у 2 больных во второй, что так же потребовало операции в объеме рассечения стриктуры уретры. Таким образом, в первой группе больных сужение пузырно-уретрального анастомоза после позадилонной радикальной простатэктомии развилось у 22 (25,2%) больных. Во второй группе больных стеноз пузырно-уретрального анастомоза развился у 6 (15,3%) пациентов. При анализе результатов сопоставления данных содержания уровня креатинина в отделяемом по дренажам в послеоперационном периоде и развития сужения пузырно-уретрального анастомоза выявлена взаимосвязь. Так у 28 (32,1%) больных первой группы отмечалось подтекание мочи по дренажам в послеоперационном периоде, но у 22 развилось сужение анастомоза при чем данное совпадение наблюдалось лишь у 19 (67,8%) пациентов против 9 (32,2%) пациентов у которых было повышение креатинина в отделяемом по дренажам но стриктура пузырно-утретрального анастомоза не развилась. Во второй группе у 11 (28,2%) больных было подтекание мочи по дренажам из паравезикального пространства, из них сужение пузырно-уретрального анастомоза развилось в 4 (36,4%) случаях, против 7 (63,6%) случаев повышения креатинина крови в отделяемом по дренажам у которых не развилась стриктура анастомоза. В дальнейшем в течение периода наблюдения у 6 пациентов в первой группы и 3 больных по второй отмечен рост уровня ПСА крови, что потребовало специфического лечения.
Обсуждение
При выполнении радикальной позадилоннойпростатэктомии одним из основных этапов операции является формирование шейки мочевого пузыря с целью обеспечения инконтиненции и наложение пузырно-уретрального анастомоза наиболее атравматичным способом. Прецизионная манипуляционная техника позволяет сохранить естественные механизмы удержания мочи и снизить риск развития сужения пузырно--уретрального анастомоза [6]. На наш взгляд,внутрипросветные швы при формировании анастомоза приводят к девиации слизистой кнаружи, а при невозможности абсолютно точного сопоставления слоев уретры и мочевого пузыря это приводит подтеканию мочи и деформации формирующегося просвета. Различные авторы указывают на общемировую тенденцию сокращения сроков катетеризации с целью профилактики развития стриктуры анастомоза, что может быть выполнено при достижении формирования структуры анастомоза, при этом необходимая продолжительность дренирования считается 7-9 суток [9].
Выводы
- Выполнение швов без захвата слизистой в формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомии позволяет снизить риск развития послеоперационной стриктуры на 9,9%.
- Применение невнутрипросветного шва позволяет отказаться от методики везикализации (выворачивания слизистой мочевого пузыря), что позволяет сократить время операции и снизить травматизацию тканей шейки мочевого пузыря.
1. Онкоурология: национальное руководство / под ред. В.И. Чиссова, Б.Я.Алексеева, И.Г. Русакова. М.: ГЭОТАР-Медиа, 2012. 688 с.
2. Prostate Cancer - Health Professional Version.Cancer Stat Facts: Prostate Cancer // National Cancer Institute USA:сайт. URL:https://seer.cancer.gov/statfacts/html/prost.html/(дата обращения: 31.05.2019).
3. Карчмазов А.А., Кешишев Н.Г., Огнерубова И.Н.и др. Проблема раннего восстановления удержания мочи после радикальной простатэктомии // Онкоурология. 2017. T. 13. N4. С.70-77. doi:https://doi.org/10.17650/1726-9776-2017-13-4-70-78
4. Каприн А.Д., Костин А.А., Филимонов В.Б.и др. Отдаленные результаты радикальной позадилоннойпростатэктомии // Российский медико-биологический вестник им. академика И.П. Павлова. 2015. N1. C. 120-129
5. Глыбочко П.В., Аляев Ю.Г., Рапоппорт Л.М.и др. Комбинированное лечение рубцовых осложнений позадилонной радикальной простатэктомии // Онкоурология. Материалы VIII конгресса Российского общества онкоурологов. 2013. N1 Специальный. С. 42.
6. Кирби Р.С. [KirbyR.S.] Радикальная простатэктомия: от открытой к роботической / науч. ред. Д.Ю. Пушкарь; пер. с англ. М.: ГЭОТАР-Медиа, 2011. 273 с.
7. Van Velthoven R.F., Ahlering T.E.,Peltier A. et al. Technique for laparoscopic running uretrovesical anastomosis. Thesingleknotmethod. Urology 2003. Vol. 61(4). P. 699-702.doi:https://doi.org/10.1016/s0090-4295(02)02543-8
8. КоганМ.И., Волдохин А.В. Совершенствование хирургической техники радикальной простатэктомии для снижения послеоперационной инконтиненции //Онкоурология. 2005. N 1.С. 45-53.
9. Павленко К.А., Кочин А.В., Волков Т.В. Непрерывный цистоуретероанастомоз при позадилонной радикальной простатэктомии //Онкоурология. 2009. Т. 5. N3.С. 44-48.doi: https://doi.org/10.17650/1726-9776-2009-5-3-44-48
10. Велиев Е.И. Оптимизация хирургического лечения больных локализованным раком предстательной железы:автореф. дис. ...докт.мед.наук: 14.00.40 / Велиев Евгений Ибадович. СПб., 2003. 39 с.
 Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International