Russian Federation
Russian Federation
VAK Russia 14.01.2023
UDC 61
CSCSTI 76.29
BISAC MED062000 Oncology
BISAC MED085000 Surgery / General
BISAC MED088000 Urology
Introduction:According to the information of Ministry of Health of the Russian Federation 12532 people died of prostate cancer in 2016.Detectability of the prostate cancer is increased over the past few years. It is discovered at earlier stages.Today the best practice of treatment a localized prostate cancer is the radical retropubic prostatectomy. The main method for prevention of postsurgical vesicourethral anastomosis stricture is the formation of sealed anastomosis with a exact comparison of mucous membranes without tissue tension. Purpose of the study: to investigate the early and long-term outcomes of the use of new technology on the number of postoperative strictures of the proximal urethra. Objective: to conduct a comparative study of the effect of intraluminal and non-intraluminal sutures in the vesicourethral anastomosis on the risk of postoperative vesicourethral strictures. Patients and Methods:We have performed 126 radical retropubic prostatectomies from January 2016 to December 2016.Patients are splitted in two groups. In the first group (87 patients) intraoperative vesicourethral anastomosis was performed according to classical scheme with intraluminal sutures.In the second group (39 patients) anastomosis was formed without mucous.When you put a cystourethral anastomosis operating a prostate cancer during a radical retropubic prostatectomy, it is appropriate to use suture without mucous. In our medical center formation of vesicourethral anastomosis is performed with Bicril 3/0 thread.For all patiens 5 ligatures were applied on anstomosis.Anasomosis leakage was checked by filling urinary bladder with 100 ml.All patients were examinated in 3, 6 and 9 months after the operation.The examination included computer tomography of the chest, abdomen and pelvis with contrast, transrectal ultrasonography, ultrasonography of the urinary bladder (to measure residual urine) and uroflowmetry. If the urination rate was below 15 ml/s, retrograde urethrography was performed. Main outcomesUrethral drainage was performed during 10.3 ± 3 days in the first group and during 9.9 ± 3 days in the second group.Vesicourethral anastomosis stricture was observed in 22 (25.2¬%) cases in the first group and in 6 (15.3%) cases in the second group. Сonclusions: This method allows one to avoid the eversion of the urinary bladder which decreases the operation time and probability of the bladder neck injury.
Prostate Cancer;Adenocarcinoma;Radical Prostatectomy;Vesicourethral Anastomosis;Postoperative Complications; Pathologic Constriction;Proximal Urethral Stricture
Введение
Заболеваемость раком предстательной железы является глобальной проблемой здоровья населения и занимает значимое место в структуре онкологической заболеваемости мужчин развитых стран. В последние десятилетие отмечается рост заболеваемости, так, за 2016г. по данным Минздрава России от рака предстательной железы умерло 12 532 человека [1]. В США за 6 мес. 2019г. зарегистрировано 174,650 новых случаев рака предстательной железы,что составило 9,9% от всех новых случаев злокачественных опухолей за данный период в США. Умерли за этот период в США от данного заболевания 31620 человек, что составило 5,2% смертей от всех злокачественных новообразований за этот период [2]. При этом, в связи с повышением выявляемости снизилась стадия первично-выявленного рака, что увеличило количество больных, которым можно выполнить радикальное лечение, а также снизилась смертность от рака предстательной железы. По данным Национального института рака США пятилетняя выживаемость с 2009 по 2015 гг. составила 98% [2]. В настоящее время наряду с улучшением качества диагностики рака предстательной железы повысилась частота выбора радикальной простатэктомии среди других альтернативных методов лечения [3, 4]. Одним из послеоперационных осложнений, снижающих качество жизни пациента, является формирование послеоперационных стриктур уретры, по поводу которых иногда требуются повторные оперативные вмешательства. По данным отечественных авторов рубцовый стеноз уретры встречается у 1,3 - 22% больных. По данным национального института рака США (NationalCancerInstitute) рубцовый стеноз уретры встречается у 17,5% пациентов, перенесших радикальную простатэктомию любым из доступов (позадилонная, промежностная, лапароскопическая, роботизированная простатэктомия) [2]. По данным отечественных авторов рубцовые изменения, осложняющие послеоперационный период нарушением мочеиспускания, формируются в течение первых трех месяцев и занимают третье место в ряду осложнений [5]. Одним из факторов формирования данного осложнения является неадекватное сопоставление слизистой оболочки уретры и мочевого пузыря, несостоятельность анастомоза. По современным представлениям основным методом профилактики стриктуры является формирование герметичного анастомоза с четким сопоставлением слизистыхоболочек без натяжения тканей [6]. В 2003г. был предложен непрерывный шов пузырно-уретрального анастомоза, описанный R.F. vanVelthoven [7]. Многие авторы указывают на формирование анастомоза выворачивающими швами (везикализация) [8]. В литературе одним из важных факторов профилактики формирования стриктуры указывается сокращение сроков дренирования мочевого пузыря уретральным катетером, что снижает риск инфицирования мочевыводящих путей [9]. Сроки катетеризации мочевого пузыря при оперативном хирургическом лечении в настоящее время пытаются сократить до 10-14 суток [10].
Цель:исследовать ранние и отдаленные результаты применения методики исключениявнутрипросветных швов в формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомии.
Задача: провести сравнительное исследование влияниявнутрипросветныхи не внутрипросветныхшвов при формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомиина формирование послеоперационных стриктур задней уретры.
Материалы и методы
Нами проанализированы результаты лечения 126 пациентов, которым в онкоурологиеском отделении ГВКГ им.Н.Н.Бурденко за период с 1 января 2016г. по 31 декабря 2018г. была выполнена позадилонная радикальная простатэктомия. Всем пациентам по общепринятым диагностическим, клиническим, лабораторным и инструментальным методикам был установленлокализованный рак предстательной железы. Пациенты, включенные в исследование, были обследованы по стандартной методике в объеме клинико-лабораторного обследования, ультразвукового исследования, компьютерной томографии. Все больные были разделены на две группы: в первую (контрольную) группу вошли пациенты (87 человек), которым интраоперационно пузырно-уретральный анастомоз выполнялся по классической методике с формированием шейки мочевого пузыря по типу «теннисной ракетки» и наложением внутрипросветных швов на анастомоз. Во вторую группу (основную) включены больные (39 пациентов) которым анастомоз формировался без применения внутрипросветных швов с выколом иглы в подслизистом слое (Рис. 1).
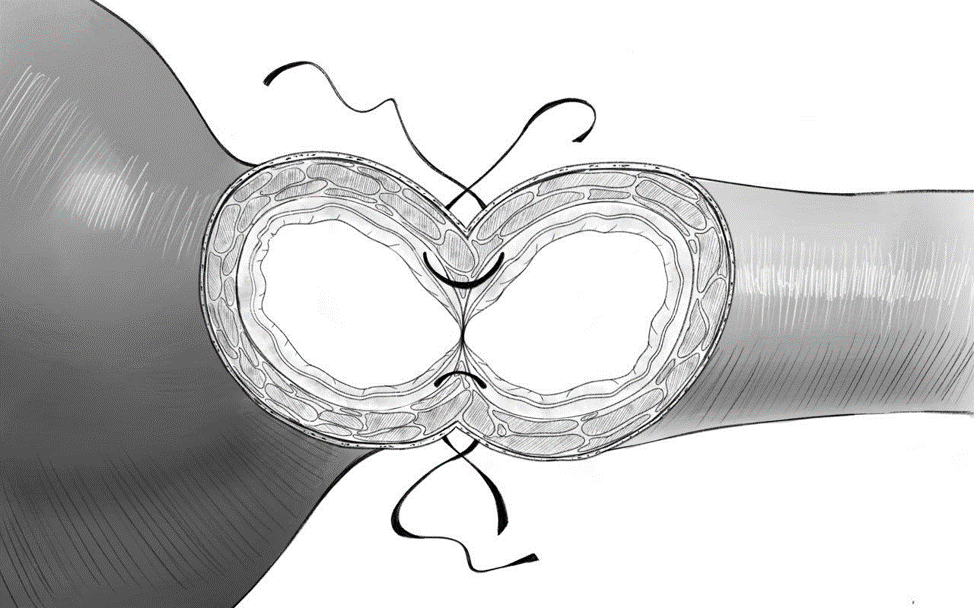
Рис.1. Схема наложения швов пузырно-уретрального анастомоза.
Fig. 1. The scheme of suturing vesico-urethral anastomosis.
У всех пациентов непосредственно на пузырно-уретральный анастомоз накладывалось 5 швов, формирование пузырно-уретрального анастомоза выполнялось нитью Vicril 3/0. Состоятельность анастомоза контролировалась наполнением мочевого пузыря посредством катетера до 100мл. 0,5% р-ром хлорида натрия. Наполнение баллона катетера производилось до 17мл. В послеоперационном периоде контроль состоятельности анастомоза оценивался исследованием уровня кретатинина в отделяемом по дренажам из паравезикальной клетчатки на 1-3 сутки.
Средний возраст больных в первой группе составил 67 ± 7,3 года (49-75 лет). Средний возраст больных во второй группе составил 66 ± 6,2 года (50-73 года).
В первой группе распределение больных по стадиям согласно гистологическом исследованию удаленного органа было следующим: рТ2аN0M0 – 17 пациентов, рТ2bN0M0 – 38 пациентов, рТ2сN0M0 – 11 больных, рТ3аN0M0 – 14 больных и рТ3bN0M0 – 7 пациентов. Во второй группе распределение больных по стадиям согласно гистологическом исследованию удаленного органа было следующим: рТ2аN0M0 - 7 пациентов, рТ2bN0M0 – 12 пациентов, рТ2сN0M0 – 6 больных, рТ3аN0M0 – 8 больных и рТ3bN0M0 – 6 пациентов.
Средний уровень простатического специфического антигена (ПСА) крови в первой группе составил 13,5 нг/мл, во второй - 12,2 нг/мл. Сумма Глисона как в первой, так и во второй группе был меньше или равен 7.
В послеоперационном периоде у 13 больных первой группы выявлен положительный хирургический край, по поводу чего проводилась дистанционная лучевая терапия. У 4 пациентов второй группы выявлен положительный хирургический край, что потребовало последующего проведения дистанционной лучевой терапии. В первой группе больных средний объем предстательной железы составил 66 ± 7см/3. Во второй группе пациентов средний объем железы составлял 69 ± 9 см/3. В контрольной группе больных нервосберегающаяпростатэктомия выполнена 19 (21,8%) пациентам во второй группе 8 (20,5%) больным. Данным больным операция была выполнена с сохранением пубо-простатических связок. В первой группе больных средний койко-день сохранения дренирования уретральным катетером составил 10,3 ± 3 дня, во второй 9,9 ± 3 дня что статистически является не значимым различием.
Результаты
Всем пациентам проводилось контрольное обследование через 3, 6 и 9 месяцев после операционного периода. В план обследования входила компьютерная томография органов грудной, брюшной полости и малого таза с пероральным и внутривенным контрастированием; ТРУЗИ, УЗИ мочевого пузыря с определением остаточной мочи и урофлоуметрия. При скорости мочеиспускания ниже 15 мл/с выполнялась ретроградная уретрография.
В первой группе больных у 7 отмечен рост ПСА, что потребовало проведения дистанционной лучевой терапии и гормонотерапии (антиандрогены + аналоги гонадотропин-рилизинг факторов) в течение 6 мес. Во второй группе больных таких пациентов было 7. Из них шести больным проведена дистанционная лучевая терапия и гормональная терапия. Один пациент из второй группы отказался от дистанционной лучевой терапии и получал только гормональную терапию в течение 6 мес. В нашем исследовании после удаления уретрального катетера ни у одного больного не развилось острой задержки мочеиспускания и при обследовании, по данным ультразвукового исследования, не было выявлено остаточной мочи более 50мл. Результаты полученные при исследовании мочеиспускания представлены в таблице 1.
Таблица 1.Виды задержки мочеиспускания и сроки развития ухудшения мочеиспускания у пациентов основной и контрольной групп
Table 1. The types of urinary retention and timing of development of the deterioration of urinationin patinets
|
|
|
I группа (n=87) I group |
IIгруппа (n=39) IIgroup |
|
1 |
Задержка мочеиспускания после удаления уретрального катетера Urinary retention after urethral catheter removal |
- |
- |
|
2 |
Острая задержка мочеиспускания в течение 3 мес. Acute urinary retention in 6 months |
7(8,0%) |
1(2,5%) |
|
3 |
Стриктура выявлена через 3 мес. Stricture was detected in 3 months |
8(9,2%) |
2(5,1%) |
|
4 |
Острая задержка мочеиспускания в течение 6 мес. Acute urinary retention in 6 months |
- |
- |
|
5 |
Стриктуравыявленачерез 6 мес. Stricture was detected in 6 months |
6(6,8%) |
1(2,5%) |
|
6 |
Острая задержка мочеиспускания в течение 9 мес. Acute urinary retention in 9 months |
- |
- |
|
7 |
Стриктуравыявленачерез 9 мес. Stricture was detected in 9 months |
1(1,15%) |
2(5,1%) |
Средняя скорость мочеиспускания при выявленном сужении уретры в первой группе больных составила 6 мл/с во второй 5мл/с. При этом средний объем остаточной мочи у пациентов, имеющих стриктуру пузырно-уретрального анастомоза в первой группе составил 87 ± 8мл/с, во второй 96 ± 9мл/с. Всем пациентам с выявленным сужением пузырно-уретрального анастомоза выполнена внутренняя оптическая уретротомия. Рецидив сужения развился у 5 больных первой группы и у 2 больных во второй, что так же потребовало операции в объеме рассечения стриктуры уретры. Таким образом, в первой группе больных сужение пузырно-уретрального анастомоза после позадилонной радикальной простатэктомии развилось у 22 (25,2%) больных. Во второй группе больных стеноз пузырно-уретрального анастомоза развился у 6 (15,3%) пациентов. При анализе результатов сопоставления данных содержания уровня креатинина в отделяемом по дренажам в послеоперационном периоде и развития сужения пузырно-уретрального анастомоза выявлена взаимосвязь. Так у 28 (32,1%) больных первой группы отмечалось подтекание мочи по дренажам в послеоперационном периоде, но у 22 развилось сужение анастомоза при чем данное совпадение наблюдалось лишь у 19 (67,8%) пациентов против 9 (32,2%) пациентов у которых было повышение креатинина в отделяемом по дренажам но стриктура пузырно-утретрального анастомоза не развилась. Во второй группе у 11 (28,2%) больных было подтекание мочи по дренажам из паравезикального пространства, из них сужение пузырно-уретрального анастомоза развилось в 4 (36,4%) случаях, против 7 (63,6%) случаев повышения креатинина крови в отделяемом по дренажам у которых не развилась стриктура анастомоза. В дальнейшем в течение периода наблюдения у 6 пациентов в первой группы и 3 больных по второй отмечен рост уровня ПСА крови, что потребовало специфического лечения.
Обсуждение
При выполнении радикальной позадилоннойпростатэктомии одним из основных этапов операции является формирование шейки мочевого пузыря с целью обеспечения инконтиненции и наложение пузырно-уретрального анастомоза наиболее атравматичным способом. Прецизионная манипуляционная техника позволяет сохранить естественные механизмы удержания мочи и снизить риск развития сужения пузырно--уретрального анастомоза [6]. На наш взгляд,внутрипросветные швы при формировании анастомоза приводят к девиации слизистой кнаружи, а при невозможности абсолютно точного сопоставления слоев уретры и мочевого пузыря это приводит подтеканию мочи и деформации формирующегося просвета. Различные авторы указывают на общемировую тенденцию сокращения сроков катетеризации с целью профилактики развития стриктуры анастомоза, что может быть выполнено при достижении формирования структуры анастомоза, при этом необходимая продолжительность дренирования считается 7-9 суток [9].
Выводы
- Выполнение швов без захвата слизистой в формировании пузырно-уретрального анастомоза при выполнении радикальной простатэктомии позволяет снизить риск развития послеоперационной стриктуры на 9,9%.
- Применение невнутрипросветного шва позволяет отказаться от методики везикализации (выворачивания слизистой мочевого пузыря), что позволяет сократить время операции и снизить травматизацию тканей шейки мочевого пузыря.
1. Chissov VI, Alekseev BYa, Rusakov IG, editors. Onkourologiya: natsionalnoerukovodstvo [Oncourology. National guidelines]. Moscow, GEOTAR Media Publishing Group, 2012. (In Russ.).
2. Seer.Cancer.gov [Internet]. National Cancer Institute USA. Prostate Cancer - Health Professional Version. Cancer Stat Facts: Prostate Cancer [cited 2019 May 31]. Available from: https://seer.cancer.gov/statfacts/html/prost.html/
3. KachmazovAA, Keshishev NG, Ognerubova IN et al. The problem of early continence recovery after radical prostatectomy. Onkourologiya [Cancer Urology]. 2017;13(4):70-78. (In Russ.). doi:https://doi.org/10.17650/1726-9776-2017-13-4-70-78
4. Kaprin AD, Kostin AA, Filimonov VBet al. Long-term results of radical retropubic prostatectomy.Rossiisky medico-biologicheskyvestnikim. Academica I.P. Pavlova [Russian medical and biological Bulletin academician I. P. Pavlov]. 2015;23(1):120-129.
5. Glibochko PV, Alaev UG, Rapopport LM et al. Combined treatment of cicatricial complications of retropubic radical prostatectomy. Materials of the VIII Congress of the Russian society of oncourologists; 2013 Oct 2-4; Moscow, Russia. Onkourologiya [Cancer Urology]. 2013;9(1S):42. (In Russ.).doi:https://doi.org/10.17650/1726-9776-2013-9-1S
6. Kirby R, Montorsi F, Pushkar DYu [et al], edtors. Radical prostatectomy: from open to robotic. Moscow: GEOTAR Media Publishing Group; 2011. (In Russ.).
7. Van Velthoven RF, AhleringTE.,Peltier Technique for laparoscopic running uretrovesical anastomosis. The single knot method. Urology. 2003; 61:699-702.
8. Kogan MI, Voldochin AV. Improvement of surgical technique of radical prostatectomy to reduce postoperative incontinence. Onkourologiya [Cancer Urology]. 2005;1(1):45-53. (In Russ.).
9. Pavlenko KA, Kochin AV, Volkov TV. Continuous cystourethral anastomosis in radical retropubic prostatectomy. Onkourologiya [Cancer Urology]. 2009;5(3):44-48. (In Russ.). doi:https://doi.org/10.17650/1726-9776-2009-5-3-44-48
10. VelievEI. Optimization of surgical treatment of patients with localized prostate cancer. Abstract of a thesis. Dissertation for a degree of MD. St. Petersburg: Army Medical College; 2003. (In Russ.).