ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва (Кафедра общей врачебной практики и поликлинической терапии, Доцент)
Россия
Москва, Россия
Россия
ВАК 14.01.2004 Внутренние болезни
ВАК 14.01.2029 Нефрология
УДК 61 Медицина. Охрана здоровья
ГРНТИ 76.29 Клиническая медицина
ОКСО 31.06.2001 Клиническая медицина
ОКСО 31.08.54 Общая врачебная практика (семейная медицина)
ОКСО 31.07.01 Клиническая медицина
ББК 53 Клиническая медицина в целом
ТБК 573 Клиническая медицина в целом
BISAC MED027000 Endocrinology & Metabolism
BISAC MED045000 Internal Medicine
BISAC MED055000 Nephrology
Введение. Острое повреждение почек (ОПП) - грозное потенциально обратимое состояние. Исходом ОПП может являться полный регресс проявлений, формирование хронической болезни почек (ХБП), вплоть до развития терминальной почечной недостаточности, а порой и смерти больного. Одной из причин развития ОПП является гиперкальциемия вследствие длительного приема и/или передозировки препаратов витамина D и кальция. Клиническое наблюдение. Приводится клиническое наблюдение рецидивирующих ОПП с исходом в хроническую болезнь почек на фоне хронической гиперкальциемии у муж-чины 59 лет, длительно принимавшего препарат витамина D дигидротахистерол и препараты кальция по поводу послеоперационного гипопаратиреоза. После пяти лет постоянного бесконтрольного приема у больного манифестировали рецидивирующие эпизоды острой почечной недостаточности, проводилось лечение с положительным эффектом, после чего пациент самостоятельно и бесконтрольно продолжал прием препаратов витаминов D и кальция. Через 11 лет приема препаратов витамина D (дигидротахистерол) и кальция после серии рецидивирующих ОПП и нарастании явлений почечной недостаточности при пункционной биопсии почки выявлен нефрокальциноз с хроническим интерстициальным нефритом, диагностирована ХБП (С4А3). Заключение. Пациенты, постоянно принимающие препараты витамина D и кальция, нуждаются в лабораторном контроле уровня витамина D и кальция с целью недопущения гипервитаминоза D, гиперкальциемии, ее недооценке и развития грозных осложнений - гиперкальциемических кризов и ОПП.
гипопаратиреоз, витамин D, дигидротахистерол, передозировка, гиперкальциемия, гипервитаминоз Д, острое повреждение почек, нефрокальциноз, хроническая болезнь почек
Введение
Острое повреждение почек (ОПП), в английской литературе - acute kidney injury (AKI) – сравнительно недавно введенный термин для замены понятия «острая почечная недостаточность» с целью унификации критериев диагностики и стратификации тяжести острого поражения (дисфункции) почек. Под ОПП понимают острое (часы, неделя), потенциально обратимое повреждение почечной паренхимы различной этиологии и патогенеза со снижением или без снижения экскреторной функции почек. ОПП верифицируется при наличии одного из следующих критериев: повышение концентрации креатинина в сыворотке крови (SCr) на ≥ 0,3 мг/дл (≥ 26,5 мкмоль/л) в течение 48 часов; или повышение SCr до ≥ 1,5 раз по сравнению с исходным уровнем (если это известно, или предполагается, что это произошло в течение предшествующих 7 дней); или объем мочи <0,5 мл/кг/час за 6 часов [1,2]. Распространенность ОПП значительно различается в общей популяции и у пациентов, находящихся в стационаре или получающих лечение в отделениях реанимации. Имеются данные о нарастании заболеваемости ОПП на 400% с 1988 по 2002 [3], что, очевидно, связано со стандартизацией критериев диагностики ОПП, пониманием патогенетических механизмов развития почечного повреждения и улучшением материально-технической базы медицинских учреждений. ОПП может встречаться в отделениях реанимации примерно у 50% критических больных, 19% из которых нуждается в заместительной почечной терапии [4]. Развитие ОПП значительно отягощает состояние больных и увеличивает летальность [5]. Исходами ОПП может быть полное восстановление функции почек, частичное восстановление с формированием той или иной стадии хронической болезни почек (ХБП), а также развитие терминальной почечной недостаточности.
Имеется большое число причин, которые могут вызвать развитие ОПП, условно их подразделяют на преренальные - вследствие циркуляторных нарушений, ренальные - вследствие повреждения гломерулярной мембраны с развитием внтуриканальцевой обструкции и постренальные - за счет обструкции мочевых путей [6]. Одной из возможных причин развития повреждения почек является гиперкальциемия вследствие приема препаратов витамина D, в частности дигидротахистерола, который применяется для коррекции гипокальциемии на фоне гипопаратиреоза, остеопороза, почечной остеодистрофии, тетании.
Наиболее распространённая причина развития транзиторного или стойкого гипопаратиреоза – тиреоидэктомия [7,8]. Послеоперационный гипопаратиреоз развивается у 30-60% пациентов после хирургических вмешательств на области шеи, из них в 60-70% случаях носит переходящий характер. Распространенность, выраженность и стойкость послеоперационного хронического гипопаратиреоза зависит от числа сохранившихся паращитовидных желез: 16% при сохраненных 1–2 железах, 6% при 3 железах и 2,5% при 4-х [9,10]. При сниженном синтезе паратгормона паращитовидными железами развивается гипокальциемия [11]. С целью лечения послеоперационного гипопаратиреоза с гипокальциемией больные получают препараты кальция и витамина D [12].
Побочным эффектом приема дигидротахистерола является гиперкальциемия, которая, в свою очередь, вызывает спазм афферентных артериол, снижает почечный кровоток, клубочковую фильтрацию, угнетает реабсорбцию в канальцах натрия, магния и калия, повышает реабсорбцию бикарбоната, увеличивает экскрецию кальция и ионов водорода. Избыточная потеря натрия с мочой и неспособность почек концентрировать мочу могут частично объяснить такие симптомы как полиурия и полидипсия, характерные для пациентов с гиперкальциемией [13].
Нормальным уровнем кальция в крови принято считать уровень 2,0-2,5 ммоль/л (8-10 мг/дл), ионизированного кальция – 1,0-1,4 ммоль/л (4,0-5,6 мг/дл). Умеренной гиперкальциемией считается содержание общего кальция 2,63-3,0 ммоль/л (10,5-12,0 мг/дл), выраженной гиперкальциемией – 3,0-3,5 ммоль/л (12,0-14 мг/дл)[14]. Содержание общего кальция более 3,5 ммоль/л (14 мг/дл) может вызывать угрожающее состояние - гиперкальциемический криз, требующий неотложной помощи [15].
Острая гиперкальциемия сопровождается развитием слабости, полидипсии, полиурии, тошнотой, рвотой, повышением артериального давления (АД), сменяющееся при развитии дегидратации гипотонией, заторможенностью и ступором. При хронической гиперкальциемии указанные симптомы выражены менее ярко. При гистологическом исследовании в ткани почки находят признаки интерстициального фиброза, могут определяться кристаллы кальция в мозговом веществе, вызывая нефрокальциноз и нефролитиаз. Лабораторно это проявляется умеренной протеинурией, эритроцитурией, той или иной степенью выраженности азотемией. Лечение направлено на устранение причины гиперкальциемии (отмены соответствующих препаратов), для восстановления объема внеклеточной жидкости проводится инфузионная терапия физиологическим раствором 1,0-
Клиническое наблюдение
Мужчина Г., 59 лет, одиннадцать лет назад перенес тиреоидэктомию по поводу фолликулярного рака щитовидной железы с развитием послеоперационного гипотиреоза и гипопаратиреоза, после чего проводилась постоянная заместительная терапия L-тироксином 150 мкг/сутки, витамином Д и кальцием. В течение двадцати лет отмечал повышение АД с максимальным цифрами до 200/120 мм рт. ст., постоянно принимал амлодипин 10 мг в сутки, адаптирован к 120/80 мм рт. ст.
Через 5 лет после операции в течение одного месяца принимал нестероидные противовоспалительные препараты (НПВС) с целью обезболивания по поводу перелома ребра. В тот же период у пациента отмечалось повышение креатинина до 549 мкмоль/л, мочевины до 17,1 ммоль/л, мочевой кислоты до 712 мкмоль/л, была диагностирована острая почечная недостаточность лекарственного генеза, проводилась терапия внутривенными инфузиями физиологического раствора 800-1200 мл/сутки, сорбентами, после нормализация уровня креатинина крови был назначен аллопуринол 300 мг/сутки. После этого чувствовал себя хорошо, через 8 лет после операции при однократном динамическом наблюдении креатинин крови составлял 104 мкмоль/л.
Через десять лет после операции в течение двух месяцев повторно появились рецидивирующие повышения креатинина крови до 548 мкмоль/л, мочевины - до 13 ммоль/л; на фоне терапии отмечалось снижение креатинина крови до 192 мкмоль/л, мочевины - до 8,4 ммоль/л. Еще через два месяца состояние больного ухудшилось: появилась общая слабость, недомогание, тремор рук, снижение аппетита, тошнота. При исследовании крови определялись: анемия (гемоглобин - 102 г/л), повышение креатинина до 511 мкмоль/л, мочевины - до 14,1 ммоль/л, мочевой кислоты - до 692 мкмоль/л; при исследовании мочи: протеинурия - до 0,27 г/л, лейкоцитурия - до 12-15 в поле зрения, эритроцитурия - до 1-2 в поле зрения; суточная протеинурия -
Через три месяца появились слабость и анорексия, при исследовании крови отмечалось повышение креатинина – до 457 - 550 мкмоль/л, мочевины - до 16,5 ммоль/л, мочевой кислоты – до 616 мкмоль/л; кальция – до 2,85 ммоль/л, анемия (гемоглобин – 91 г/л); гормоны щитовидной и паращитовидных желез: ТТГ - 0,23 мкме/л, Т4 свободный - 15,9 пмоль/л, ПТГ - 4,1 пкг/мл; при исследованиях мочи: протеинурия - 0,32 г/л, лейкоцитурия - 4-6 в поле зрения, эритроцитурия - 0-1 в поле зрения, суточная протеинурия - 0,8 г. Было диагностировано ОПП, послеоперационный гипотиреоз, гипопаратиреоз. Проводилась терапия: кетостерил 15 таблеток/сутки, L-тироксин 100 мкг/сутки, кальция карбонат + колекальциферол (кальций-D3) 1000 мг/сутки, дигидротахистерол 15 капель/сутки, моксонидин (физиотенз) 0,2 мг/сутки, обильное питье.
На фоне лечения было отмечено улучшение состояния и лабораторных показателей, при исследовании крови: гемоглобин - 96 г/л, общий белок – 72 г/л, креатинин - 302 мкмоль/л, мочевина – 11 ммоль/л, мочевая кислота – 424 мкмоль/л, кальций общий – 2,6 ммоль/л, кальций ионизированный - 1,4 ммоль/л; при исследовании мочи: протеинурия - 0,36 г/л, лейкоцитурия - 2-6 в поле зрения, эритроцитурия 25-30 в поле зрения; суточная протеинурия - 0,6 г/л.
В связи с неясным генезом рецидивирующих ОПП была выполнена пункционная биопсия почки, по результатам которой определялись: диффузно-очаговый склероз интерстиция и атрофия канальцев, занимающие около 60-70 % почечной паренхимы. Диффузно-очаговая инфильтрация интерстиция мононуклеарами в зонах склероза с явлениями тубулита (до 2-3 клеток на срез канальца) в атрофичных канальцах. В стенке канальцев и интратубулярно имеются многочисленные отложения микролитов солей кальция, не дающих двойного лучепреоломления при исследовании в поляризованном свете (фосфаты). Артерии – артериосклероз. Заключение: нефрокальциноз, хронический интерстициальный нефрит (Рис. 1).
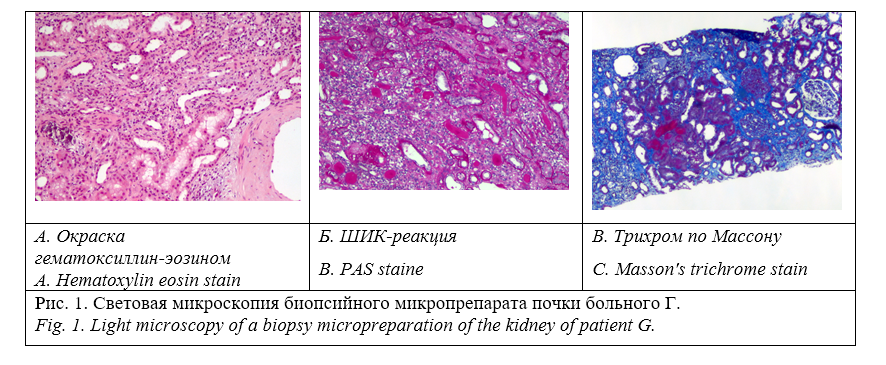
Таким образом, в результате длительного постоянного приёма дигидротахистерола и препаратов кальция по поводу послеоперационного гипопаратиреоза, у пациента развилась хроническая медикаментозная гиперкальциемия, осложнившаяся рецидивирующим ОПП, формированием хронического тубулоинтерстициального нефрита (обусловленного отложением солей кальция и уратного) и нефрокальциноза с развитием ХБП (С4А3).
Терапия была скорректирована: доза L-тироксина была снижена до 125 мкг/сутки; в связи с сохраняющейся гиперкальциемией - 2,74 ммоль/л, доза дигидротахистерола была снижена до 10 капель/сутки; продолжен прием амлодипина 10 мг, бисопролола 2,5 мг/сутки, аторвостатина 10 мг, аллопуринола 200 мг/сутки, внутривенные инфузии физиологического раствора 800 мл/сутки. На фоне лечения было отмечено улучшение: снижение в крови креатинина до 276 мкмоль/л, мочевины – до 9,3 ммоль/л, нормализации мочевой кислоты - 398,7 мкмоль/л, некоторое повышение гемоглобина – до 112 г/л. Доза дигидротахистерола была уменьшена до 3 капель/сутки, в результате чего ионизированный кальций нормализовался – 1,29-1,32 ммоль/л, кальций общий нормализовался - 2,39 ммоль/л, однако, отмечалось повышение: креатинина - до 298 мкмоль/л, мочевины - до 10,4-12,9 ммоль/л, мочевой кислоты – до 369-411 мкмоль/л; при исследовании мочи отмечалась суточная протеинурия - 0,37 г. АД нормализовалось на уровне 120/80 мм рт.ст., отмечалось дальнейшее снижение уровня азотистых шлаков, нормализация уровня кальция крови. Продолжена терапия: дигидротахистерол в прежней дозе - 3 капли/сутки, L-тироксин - 125 мкг/сутки, аллопуринол - 200 мг/сутки, бисопролола - 2,5 мг/сутки.
Обсуждение
Дозы дигидротахистерола устанавливают индивидуально в зависимости от целей назначения. По информации производителей, обычная суточная доза дигидротахистерола составляет 0,5–1,5 мг (12–36 капель), доза устанавливается в зависимости от содержания кальция в сыворотке крови и моче. Используемая пациентом доза – 15 капель/сутки не превышала обычную суточную дозу, но контроль содержания витамина Д и кальция в крови и моче не проводился.
Длительный прием дигидротахистерола, других препаратов витамина Д и препаратов кальция без контроля уровня кальция крови может приводить к гиперкальциемии и вызывать ОПП. ОПП может быть обратимым с полным восстановлением функции почек, возможно частичное восстановление функции с развитием ХБП, а также исход в терминальную почечную недостаточность.
Сходное клиническое наблюдение, в котором отмечалось развитие гиперкальциемического криза с ОПП вследствие передозировки витамина D, описано в России у 45-летной женщины. Пациентке в возрасте 31 года была выполнена тиреоидэктомия по поводу фолликулярного рака щитовидной железы, после чего она постоянно получала заместительную терапию дигидротахистеролом и другими препаратами витамина D, препаратами кальция. Через 9 лет была выявлена гиперкальциемия, а через 11 лет - повышение креатинина сыворотки крови и снижение скорости клубочковой фильтрации. Рецидивирующая гиперкальциемия осложнилась ОПП на фоне ХБП, при консервативной терапии уровень азотемии снизился [16], к сожалению, дальнейшее наблюдение за пациенткой не описано. Похожее клиническое наблюдение ОПП c анемией при гиперкальциемии, вызванной передозировкой препаратов витамина D у пациентки после тиреоидэктомии было описано в Тайланде, после лечения ОПП и коррекции заместительной терапии симптомы поражения почек полностью исчезли [17].
Широкое использование препаратов витамина D в лечении остепороза также может приводить к гиперкальциемии с ОПП, так, например, в Японии в одном из городских госпиталей описаны 32 таких случая ОПП, что составило 46,4% всех ОПП, зарегистрированных в данном лечебном учреждении за неполный 5-летний период с 2013 по 2018. При этом отмечена тенденция к повышению уровня кальция и кретинина в сыворотке крови при полипрагмазии. Было предположено, что риск развития ОПП мог возрастать при полипрагмазии, развитие ОПП чаще ассоциировалось (статистически не достоверно, возможно связано с особенностями группы больных, требует проведения дальнейших исследований) с дополнительным приемом блокаторов кальциевых каналов, блокаторов ренин-ангиотензин-альдостероновой-системы, НСПВП, антацидов на основе оксида магния, бифосфонатов, петлевых диуретиков (перечислены в порядке уменьшения значимости) [18]. Все эти больные с ОПП имели тенденцию к развитию метаболического алкалоза, но только у 5 пациентов (7,2%) развился кальциево-щелочной синдром (синдром Бернетта), включающий гиперкальциемию, метаболический алкалоз и почечную недостаточность [19,20], являющийся третьим по встречаемости исходом гиперкальциемии [21,22].
Нефрокальциноз вследствие приема витамина D у взрослых пациентов является редким, чаще встречается у детей младшего возраста и связан с приемом витамина D для лечения и профилактики рахита. В Германии в многоцентровом исследовании 152 детей с выявленным нефросклерозом установлено, что у 14 детей (у 9 %) нефросклероз был связан с приемом витамина D с профилактической целью [23].
Встречаются случаи нефрокальциноза и вследствие передозировки витамина D. В Индии под наблюдением находились 7 детей в возрасте от 7,5 до 25 месяцев (6 девочек, 1 мальчик), с клиническими признаками гиперкальциемии. Все дети получали витамин D в дозах от 900 000 до 4 000 000 МЕ (разрешенная максимальная терапевтическая доза 2000 МЕ), а продолжительность приёма варьировала от 2 до 8 недель. У всех пациентов лабораторно отмечались: гиперкальциемия, гиперкальциурия, повышенный уровень 25(ОH)-витамина D и подавленный уровень паратиреоидного гормона. В двух случаях наблюдалось увеличение креатинина в сыворотке крови, а нефрокальциноз, подтверждённый биопсией почек, выявился в 5 случаях [24].
Во Франции был описан случай гиперкальциемии вследствие интоксикации витамином D у мальчика 4-х месячного возраста, который получал большие дозы витамина D, (конкретную дозу установить не удалось). Клиническими проявлениями были: гипотония, признаки умеренной внутриклеточной дегидратации, полиурия, гиперкальциемия (4,28 - 4,55 ммоль/л) и лейкоцитурия. Признаков дисфункции почек у пациента не наблюдалось, но отмечался нефросклероз. Лечение было эффективным с благополучным исходом заболевания [25].
Случаи развития нефросклероза у детей на фоне непродолжительного приема больших доз витамина D свидетельствуют о необходимости строгого контроля за режимом дозирования витамина D, принимаемого с целью профилактики и лечения рахита [26].
Гиперкальциемия часто встречается при первичным гиперпаратиреозе, при стойкой длительной гиперкальциемии могут поражаться почки с развитием ХБП. В России описано клиническое наблюдение пациента: мужчины, которому в 56 летнем возрасте выполнено удаление аденомы нижней околощитовидной железы, а через 4 года после длительного гемодиализа по поводу ХБП (5с), пациенту выполнена трансплантация трупной почки [27].
Похожий клинический случай был описан в Дании у мужчины, 64 лет, у которого при обследовании по поводу ХБП выявлены аденома паращитовидной железы, гиперкальциемия, выраженный двусторонний нефрокальциноз, повышение ПТГ, снижение плотности костной ткани. После удаления аденомы околощитовидной железы уровень кальция в плазме нормализовался, но из-за ухудшения функции почек пациент был направлен на гемодиализ и трансплантацию почки [28].
Заключение
В связи с частой встречаемостью послеоперационного гипопаратиреоза, высокой распространенностью дефицита витамина D у детей и взрослых в мире [26] и Российской Федерации [29] и повышением информированности врачей об этих состояниях, назначение препаратов витамина D для профилактики и лечения может стать более распространенным не только среди эндокринологов и педиатров, но и среди врачей общей практики и терапевтов. Однако, бесконтрольный прием и передозировка препаратов витамина D могут привести к тяжелым осложнениям.
Данное клиническое наблюдение показывает, что длительный прием препаратов витамина D, в описанном случае - дегидротахистерола, может приводить к развитию хронической гиперкальциемии, с рецидивирующим ОПП, формированием хронического тубулоинтерстициального нефрита, нефрокальциноза и, как следствие, развитием ХБП. Пациенты, постоянно принимающие препараты витамина D, нуждаются в лабораторном контроле уровня кальция и 25-гидроксивитамина D (25(OH)-витамин D) (кальцидиол) каждые 6 месяцев [30–32] с целью недопущения гипервитаминоза D и возможной гиперкальциемии; контроле уровня азотистых шлаков, а при ухудшении состояния пациента необходимо оценивать состояние кальций-фосфорного обмена для своевременного предупреждения развития ОПП.
Риск развития ОПП может возрастать при полипрагмазии, особенно при приеме блокаторов кальциевых каналов, блокаторов ренин-ангиотензин-альдостероновой-системы, НСПВП, антацидов на основе оксида магния, бифосфонатов, петлевых диуретиков.
Отсутствие настороженности врачей может привести к несвоевременной диагностике гипервитаминоза D, гиперкальциемии, ее недооценке и развитию грозных осложнений - гиперкальциемических кризов, нефрокальциноза и ОПП.
Поддерживать уровень кальция крови рекомендовано ближе к нижней границе нормы при нормальных показателях экскреции кальция с мочой.
1. Levey A.S., James M.T. Acute Kidney Injury. // Ann. Intern. Med. 2017. Vol. 167, № 9. P. ITC66-ITC80. DOI: https://doi.org/10.7326/AITC201711070.
2. KDIGO Clinical Practice Guideline for Acute Kidney Injury // Kidney Int. Suppl. 2012. Vol. 2, № 1. P. 6. DOI: https://doi.org/10.1038/kisup.2012.6.
3. Case J. et al. Epidemiology of Acute Kidney Injury in the Intensive Care Unit // Crit. Care Res. Pract. 2013. Vol. 2013. P. 1-9. DOI: https://doi.org/10.1155/2013/479730.
4. Cartin-Ceba R. et al. Evaluation of “Loss” and “End stage renal disease” after acute kidney injury defined by the Risk, Injury, Failure, Loss and ESRD classification in critically ill patients // Intensive Care Med. 2009. Vol. 35, № 12. P. 2087-2095. DOI: https://doi.org/10.1007/s00134-009-1635-9.
5. Магомедалиев М.О., Корабельников Д.И., Хорошилов С.Е. Острое повреждение почек при пневмонии // Российский медико-социальный журнал. 2019. №1. С. 59-73. doi:https://doi.org/10.35571/RMSJ.2019.1.006
6. Acute kidney injury: Current concepts and new insights // J. Inj. Violence Res. 2014. DOI: https://doi.org/10.5249/jivr.v8i1.610.
7. Burger F. et al. Postoperative Hypoparathyroidism in Thyroid Surgery: Anatomic-Surgical Mapping of the Parathyroids and Implications for Thyroid Surgery // Sci. Rep. 2019. Vol. 9, № 1. P. 15700. DOI: https://doi.org/10.1038/s41598-019-52189-3.
8. Кузнецов Н.С., Симакина О.В., Ким И.В. Предикторы послеоперационного гипопаратиреоза после тиреоидэктомии и методы его лечения // Клиническая и экспериментальная тиреоидология. 2012. Vol. 8, № 2. P. 20-30. DOI: https://doi.org/10.14341/ket20128220-30.
9. Lorente-Poch L. et al. Importance of in situ preservation of parathyroid glands during total thyroidectomy // Br. J. Surg. 2015. Vol. 102, № 4. P. 359-367. DOI: https://doi.org/10.1002/bjs.9676.
10. Grodski S., Serpell J. Evidence for the Role of Perioperative PTH Measurement after Total Thyroidectomy as a Predictor of Hypocalcemia // World J. Surg. 2008. Vol. 32, № 7. P. 1367-1373. DOI: https://doi.org/10.1007/s00268-008-9545-5.
11. Pereira J.A. et al. Nodal yield, morbidity, and recurrence after central neck dissection for papillary thyroid carcinoma // Surgery. 2005. Vol. 138, № 6. P. 1095-1101. DOI: https://doi.org/10.1016/j.surg.2005.09.013.
12. Leidig-Bruckner G. et al. Long-Term Follow-Up and Treatment of Postoperative Permanent Hypoparathyroidism in Patients with Medullary Thyroid Carcinoma: Differences in Complete and Partial Disease. // Horm. Metab. Res. 2016. Vol. 48, № 12. P. 806-813. DOI: https://doi.org/10.1055/s-0042-118181.
13. Тареева И.Е., Андросова С.О., Ермоленко В.М., и др. Справочник по нефрологии. Под ред. И. Е. Тареевой и Н. А. Мухина. М.: Медицина. 1986. 432 с.
14. Bushinsky D.A., Monk R.D. Electrolyte quintet: Calcium. // Lancet (London, England). 1998. Vol. 352, № 9124. P. 306-311. DOI: https://doi.org/10.1016/s0140-6736(97)12331-5.
15. Walsh J. et al. Society for Endocrinology Endocrine Emergency Guidance: Emergency management of acute hypercalcaemia in adult patients. // Endocr. Connect. 2016. Vol. 5, № 5. P. G9-G11. DOI: https://doi.org/10.1530/EC-16-0055.
16. Иванова Л.А., Король И.В., Мамян Н.В., Вартеванян В.В., Богрова М.И., Хугаева З.Л., Золотарева А.А., Кокова Е.А. Гиперкальциемический криз вследствие передозировки витамина D. Клинический случай // Опухоли головы и шеи. 2016. Vol. 6, № 3. P. 64-66. DOI: https://doi.org/10.17650/2222-1468-2016-6-3-64-66.
17. von Bormann S., Suksompong S., von Bormann B. A rare case of acute kidney injury and anemia induced by hypercalcemia. // Clin. Pract. 2019. Vol. 9, № 2. P. 1117. DOI: https://doi.org/10.4081/cp.2019.1117.
18. Aihara S. et al. Hypercalcemia and acute kidney injury induced by eldecalcitol in patients with osteoporosis: a case series of 32 patients at a single facility. // Ren. Fail. 2019. Vol. 41, № 1. P. 88-97. DOI: https://doi.org/10.1080/0886022X.2019.1578667.
19. Katsarou I. et al. A Case of Hypercalcemia after Thyroidectomy // BANTAO J. 2016. Vol. 14, № 2. P. 92-94. DOI: https://doi.org/10.1515/bj-2016-0022.
20. Felsenfeld A.J., Levine B.S. Milk alkali syndrome and the dynamics of calcium homeostasis. // Clin. J. Am. Soc. Nephrol. 2006. Vol. 1, № 4. P. 641-654. DOI: https://doi.org/10.2215/CJN.01451005.
21. Medarov B.I. Milk-alkali syndrome. // Mayo Clin. Proc. 2009. Vol. 84, № 3. P. 261-267. DOI: https://doi.org/10.1016/S0025-6196(11)61144-0.
22. Patel A.M., Adeseun G.A., Goldfarb S. Calcium-alkali syndrome in the modern era. // Nutrients. 2013. Vol. 5, № 12. P. 4880-4893. DOI: https://doi.org/10.3390/nu5124880.
23. Rönnefarth G., Misselwitz J. Nephrocalcinosis in children: a retrospective survey // Pediatr. Nephrol. 2000. Vol. 14, № 10-11. P. 1016-1021. DOI: https://doi.org/10.1007/s004670050065.
24. Joshi R. Hypercalcemia due to Hypervitaminosis D: Report of Seven Patients // J. Trop. Pediatr. 2009. Vol. 55, № 6. P. 396-398. DOI: https://doi.org/10.1093/tropej/fmp020.
25. Chambellan-Tison C. et al. Hypercalcémie majeure secondaire à une intoxication par la vitamine D // Arch. Pédiatrie. 2007. Vol. 14, № 11. P. 1328-1332. DOI: https://doi.org/10.1016/j.arcped.2007.08.005.
26. Roth D.E. et al. Global prevalence and disease burden of vitamin D deficiency: a roadmap for action in low- and middle-income countries // Ann. N. Y. Acad. Sci. 2018. Vol. 1430. P. 44-79. DOI: https://doi.org/10.1111/nyas.13968.
27. Мирная C.С., Мокрышева Н.Г. Клинический случай прогрессирования хронической болезни почек у пациента с первичным гиперпаратиреозом с последующей трансплантацией почки // Ожирение и метаболизм. 2016. Vol. 13, № 3. P. 71-75. DOI: https://doi.org/10.14341/omet2016371-75.
28. Grube M, Bech JN, Pedersen EB. Primary hyperparathyroidism as a cause of chronic renal failure // Ugeskrift for Laeger. 2012. Vol. 174. N 8. P. 502-503.
29. Петрушкина А.А., Пигарова Е.А., Рожинская Л.Я. Эпидемиология дефицита витамина D в Российской Федерации // Остеопороз и остеопатии. 2018. Vol. 21, № 3. P. 15-20. DOI: https://doi.org/10.14341/osteo10038.
30. Bouillon R. Optimal vitamin D supplementation strategies // Endocrine. 2017. Vol. 56, № 2. P. 225-226. DOI: https://doi.org/10.1007/s12020-017-1245-1.
31. Holick M.F. et al. Evaluation, Treatment, and Prevention of Vitamin D Deficiency: an Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. 2011. Vol. 96, № 7. P. 1911-1930. DOI: https://doi.org/10.1210/jc.2011-0385.
32. Пигарова Е. А., Рожинская Л. Я., Белая Ж. Е., Дзеранова Л. К., Каронова Т. Л., Ильин А. В., Мельниченко Г. А., Дедов И. И. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых // Проблемы эндокринологии. 2016. Vol. 62, № 4. P. 60-84. DOI: https://doi.org/10.14341/probl201662460-84.
 Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International